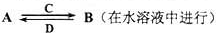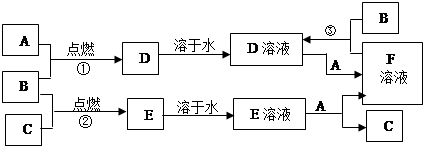题目内容
下图是由一些常见元素组成的单质及其化合物之间的转化关系图。常温常压下,D、F均为无色无味的气体,B是最常见的无色液体,A是由单质C在D中燃烧生成的淡黄色固体;G是一种红褐色沉淀,且G、H、I、J中都含有同一种元素(反应中生成的部分物质已略去)。请回答下列问题: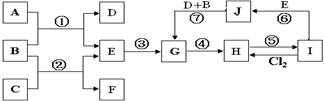
从反应②的实验现象可以得出物质C具有的某些物理性质有(写两点): 。
(2)J暴露在空气中的现象是 。
(3)①--⑦的反应中属于非氧化还原反应的有 。
(4)反应①的化学方程式为 。
(5)将115g甲酸(HCOOH)完全燃烧后的产物通过足量的固体A中,固体A将增重 g。
(1)银白色金属、固体、密度比水小、熔点低等(写到两点合理即可)
(2)白色固体迅速变成灰绿色,最后变成红褐色。 (3)③④⑥
(4)2Na2O 2+2H2O=2NaOH+O2↑ (5)75
解析试题分析:A是有单质C在D中燃烧生成的淡黄色固体,淡黄色固体为Na2O2,则C为Na,D为O2,A为Na2O2,, D、F均为无色无味的气体,B是最常见的无色液体应为H2O,则E为NaOH,F为H2,,G是一种红褐色沉淀,是Fe (OH)3,H是FeCl3,I是FeCl2,J是Fe (OH)2。
(1)钠是银白色金属固体、密度比水小、熔点低等
(2)J是Fe (OH)2暴露在空气中易被氧化成Fe(OH)3,其现象是白色固体迅速变成灰绿色,最后变成红褐色。
(3)①--⑦中③④⑥属于非氧化还原反应。
(4)A为Na2O2,反应①是Na2O2与水的反应:2Na2O 2+2H2O=2NaOH+O2↑
(5)甲酸(HCOOH)的分子式CH2O2,燃烧后产物通过Na2O2,增重的质量就是其中含有的CO和H2的质量,增重=115g×30/46=75g
考点:钠及其化合物,铁及其化合物的性质

 阅读快车系列答案
阅读快车系列答案已知甲、乙、丙和X是四种中学化学中常见的物质,其转化关系如下图,则甲和X不可能是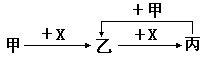
| A.甲为C,X是O2 | B.甲为SO2,X是NaOH溶液 |
| C.甲为Cl2,X为Fe | D.甲为Al,X为NaOH溶液 |
Ⅰ.下列化合物中,含有非极性共价键的离子化合物是 ( )。
| A.CaC2 | B.N2H4 | C.Na2S2 | D.NH4NO3 |
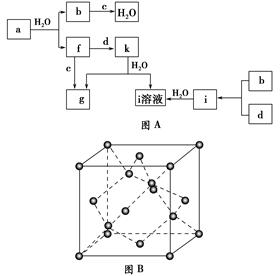
回答下列问题:
(1)图B对应的物质名称是________,其晶胞中的原子数为________,晶体类型为________。
(2)d中元素的原子核外电子排布式为________。
(3)图A中由二种元素组成的物质中,沸点最高的是________,原因是________________________________________________________________________,该物质的分子构型为________,中心原子的杂化轨道类型为________。
(4)图A中的双原子分子中,极性最大的分子是________。
(5)k的分子式为________,中心原子的杂化轨道类型为________,属于________分子(填“极性”或“非极性”)。