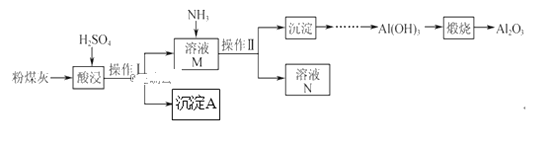
题目内容
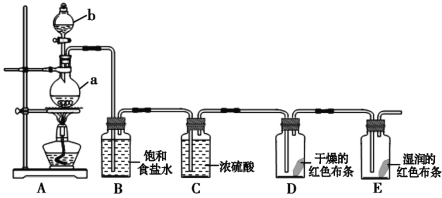
【题目】测定硫酸铜晶体(CuSO4·xH2O)结晶水含量的实验流程如下:
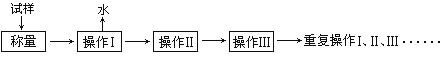
请回答:
(1)以下是实验中可能用到的几种仪器,请在图下方横线上写出仪器名称。
|
|
|
|
a. 电子天平 | b. ___________ | c. ____________ | d. 酒精喷灯 |
①“操作I”是灼烧硫酸铜晶体,将用到上述________(填序号)仪器;
②“操作Ⅱ”是____________,必须在________(填序号)中进行,否则将造成实验测定结果_____________(填“偏高”、“偏低”或“正确”)。
(2) “重复操作Ⅰ、Ⅱ、Ⅲ”,称为恒重操作。判断达到恒重的依据是____________________________________________;进行恒重操作的目的是____________________________________________。
(3)某学生实验后得到下表数据:
加热前质量 | 加热后质量 | |
m1(容器) | m2(容器+晶体) | m3(容器+无水硫酸铜) |
5.4 g | 7.9 g | 6.9 g |
① 由此该学生计算得出该硫酸铜晶体中结晶水x的值为________________(精确到0.1)。
② 指出该同学实验操作或数据处理中存在的主要问题____________(至少写2点)。
【答案】坩埚 干燥器 bd 冷却 c 偏低 相邻两次称量的质量差小于0.001g 确保晶体失去全部结晶水 5.9 未进行平行实验、数据记录应保留3小数
【解析】
测定硫酸铜晶体(CuSO4·xH2O)中结晶水含量的原理为先将晶体放在研钵中研细,然后放在坩埚中加热,直到前后两次称量的质量差不超过0.001g后停止加热,说明完全失水,再放在干燥器中冷却,最后利用加热前后的质量差来计算结晶水含量;
(1)根据仪器图形可以判断b为坩埚c为干燥器;
①“操作I”是灼烧硫酸铜晶体,则在坩埚中加热;
②根据测定硫酸铜晶体(CuSO4·xH2O)中结晶水含量的原理,“操作Ⅱ”的操作是放在干燥器中冷却;
(2)根据测定硫酸铜晶体(CuSO4·xH2O)中结晶水含量的原理,前后两次称量的质量差不超过0.001g即可认为达到恒重,说明完全失水;
(3)①根据结晶水合物中,结晶水的质量=m(容器十晶体)-m(容器十无水硫酸铜),据化学方程式可以计算结晶水x的值;
②指出该同学实验操作或数据处理中存在的主要问题:未进行平行实验、数据记录应保留3小数.
(1)根据仪器图形可以判断b为坩埚c为干燥器,故答案为:坩埚;干燥器;
①“操作I”是灼烧硫酸铜晶体,则在坩埚中加热,所以用到上述b坩埚和d酒精喷灯仪器,故选:bd;
②根据测定硫酸铜晶体(CuSO4·xH2O)中结晶水含量的原理,“操作Ⅱ”的操作是放在干燥器中冷却,所以“操作Ⅱ”的操作是冷却,必须在c干燥器中进行,否则将吸收空气中的水蒸气,造成实验测定结果偏低。故答案为:冷却;c;偏低;
(2)根据测定硫酸铜晶体(CuSO4·xH2O)中结晶水含量的原理,前后两次称量的质量差不超过0.001g即可认为达到恒重,说明完全失水,则判断达到恒重的依据是相邻两次称量的质量差小于0.001g;进行恒重操作的目的是 确保晶体失去全部结晶水;故答案为:相邻两次称量的质量差小于0.001g;确保晶体失去全部结晶水;
(3)①由表格中的数据,硫酸铜晶体的质量为7.900g-5.400g=2.500g,水的质量:7.900g-6.900g=1.000g,
则CuSO 4.xH2O![]() CuSO 4+xH2O,
CuSO 4+xH2O,
160+18x 18x
2.500g 1.000g
(160+18x)/2.500=18x/1.000
解得x≈5.9,
故答案为:5.9;
②该同学实验操作或数据处理中存在的主要问题:未进行平行实验、数据记录应保留3小数.

【题目】如图图象中,纵坐标为沉淀物的物质的量,横坐标为向溶液中加入反应物的物质的量,则相应的图像序号与(1)—(4)对应的是
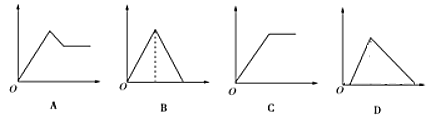
溶液 | 加入物质 | 对应的图像 |
(1)饱和石灰水 | 通过量CO2气体 | ____ |
(2)氯化铝溶液 | 加入过量氨水 | ____ |
(3)MgCl2、AlCl3的混合液 | 逐滴加入NaOH溶液至过量 | ____ |
(4)含少量NaOH的NaAlO2溶液 | 逐滴加入稀盐酸 | ____ |