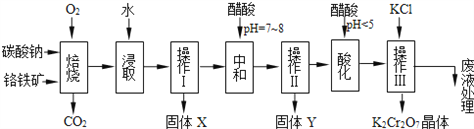
��Ŀ����
����Ŀ����������п��һ�ֶ���Ե����������ϣ�����������Ϳ�ϵȸ�������㷺��Ӧ�á���ҵ�ɴ�����п(������FeO��CuO ������) �Ʊ���������п�Ĺ�ҵ��������:
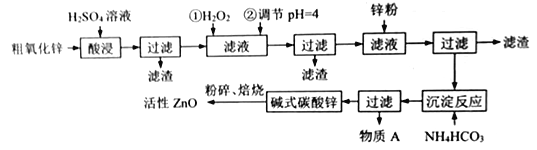
��֪:Fe3+��Fe2+��Cu2+��ȫ������pH�ֱ���:3.2��8.1��6.7
(1)�������ʱ�õ�������Һ���ܶ�Ϊ1��4g/mL����������Ϊ70%�������������ʵ���Ũ��Ϊ____��
(2)����ǰ�����Ŀ����____________________________________________��
(3)��Һ�м�п�۵�Ŀ����_____________________________________��
(4)����A����Ҫ�ɷ�_______________(�ѧʽ)������A�������ӵķ�����_______________��
(5)��Һ�м�H2O2������Ӧ�����ӷ���ʽ__________________________��
(6)6.82g��ʽ̼��п[aZn(OH)2��bZnCO3��cH2O]ǡ���ܽ���40mL3mol/LHCl�У�ͬʱ����448mLCO2(��״����)���������ʽ̼��п�Ļ�ѧʽΪ___________________________��
���𰸡� 10mol��L-1 ����Ӵ�������ӿ췴Ӧ���� ��ȥ��Һ�к��е�Cu2+���� (NH4)2SO4 ȡ������A��Һ���Թ��У������������Ʋ����ȣ�������ʹʪ��ĺ�ɫʯ����ֽ���������壬����NH4+ 2Fe2++H2O2+2H+=2H2O+2Fe3+ 2Zn(OH)2��ZnCO3��H2O
�����������������(1)����![]() ��������Ũ����(2)�����������Ӵ������ (3)��Һ�к�������ͭ������(4)����Ԫ���غ��������A����Ҫ�ɷ���(5) ������������Һ�к���Fe2+�� H2O2����Fe2+����ΪFe3+��(6)���ݷ�Ӧ����ʽaZn(OH)2��bZnCO3��cH2O+(2a+2b)HCl=��a+b��ZnCl2+bCO2
��������Ũ����(2)�����������Ӵ������ (3)��Һ�к�������ͭ������(4)����Ԫ���غ��������A����Ҫ�ɷ���(5) ������������Һ�к���Fe2+�� H2O2����Fe2+����ΪFe3+��(6)���ݷ�Ӧ����ʽaZn(OH)2��bZnCO3��cH2O+(2a+2b)HCl=��a+b��ZnCl2+bCO2![]() +(2a+b+c)H2O�������ʽ̼��п�Ļ�ѧʽ��
+(2a+b+c)H2O�������ʽ̼��п�Ļ�ѧʽ��
������(1) ![]() =
=![]() mol��L-1 ��(2)�����������Ӵ�������ӿ췴Ӧ������(3)��Һ�к�������ͭ��������п�ۿ��Գ�ȥ��Һ�к��е�Cu2+������(4)����п�۹��˺����Һ�к�������п������̼��������ɼ�ʽ̼��п������Ԫ���غ�������A����Ҫ�ɷ���(NH4)2SO4��ȡ������A��Һ���Թ��У������������Ʋ����ȣ�������ʹʪ��ĺ�ɫʯ����ֽ���������壬����NH4+��(5) ������������Һ�м���H2O2��Fe2+������ΪFe3+����Ӧ���ӷ���ʽ��2Fe2++H2O2+2H+=2H2O+2Fe3+��
mol��L-1 ��(2)�����������Ӵ�������ӿ췴Ӧ������(3)��Һ�к�������ͭ��������п�ۿ��Գ�ȥ��Һ�к��е�Cu2+������(4)����п�۹��˺����Һ�к�������п������̼��������ɼ�ʽ̼��п������Ԫ���غ�������A����Ҫ�ɷ���(NH4)2SO4��ȡ������A��Һ���Թ��У������������Ʋ����ȣ�������ʹʪ��ĺ�ɫʯ����ֽ���������壬����NH4+��(5) ������������Һ�м���H2O2��Fe2+������ΪFe3+����Ӧ���ӷ���ʽ��2Fe2++H2O2+2H+=2H2O+2Fe3+��
(6) 
![]() a=2b��
a=2b�� ![]() b=c�����Լ�ʽ̼��п�Ļ�ѧʽ��2Zn(OH)2��ZnCO3��H2O��
b=c�����Լ�ʽ̼��п�Ļ�ѧʽ��2Zn(OH)2��ZnCO3��H2O��