题目内容
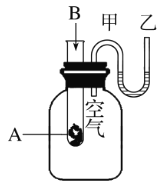
【题目】为了研究化学反应A+B![]() C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:
C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:
(1)该反应为________(填“放热”或“吸热”)反应。
(2)A和B的总能量比C和D的总能量_______(填“高”或“低”)。
(3)物质中的______能转化成______能释放出来。
(4)反应物化学键断裂吸收的能量__________(填“高”或“低”)于生成物化学键形成放出的能量。
(5)写出一个符合题中条件的化学方程式:______。
【答案】放热 高 化学 热 低 2Al+6HCl=2AlCl3+3H2↑(或2Na+2H2O=2NaOH+H2↑或NaOH+HCl=NaCl+H2O)
【解析】
当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升,说明A和B反应是放热反应,放热反应的反应物的总能量大于生成物的总能量。
(1)当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升,说明A和B反应生成C和D的反应是放热反应,故答案为:放热;
(2)放热反应的反应物的总能量大于生成物的总能量,故答案为:高;
(3)A和B反应生成C和D的反应是放热反应,反应的物质中的化学能转化成热能释放出来,故答案为:化学;热;
(4)化学反应中旧键断裂吸收能量,新键生成放出能量,A和B反应生成C和D的反应是放热反应,说明形成化学键放出的热量大于断裂化学键所吸收热量,故答案为:低;
(4)该反应为放热反应,且不需要加热即可发生,如铝与稀盐酸的反应,反应的化学方程式为:2Al+6HCl=AlCl3+3H2↑,故答案为:2Al+6HCl=AlCl3+3H2↑。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目