题目内容
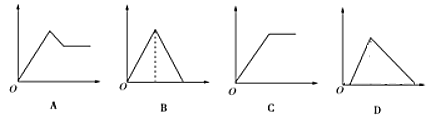
【题目】如图图象中,纵坐标为沉淀物的物质的量,横坐标为向溶液中加入反应物的物质的量,则相应的图像序号与(1)—(4)对应的是
溶液 | 加入物质 | 对应的图像 |
(1)饱和石灰水 | 通过量CO2气体 | ____ |
(2)氯化铝溶液 | 加入过量氨水 | ____ |
(3)MgCl2、AlCl3的混合液 | 逐滴加入NaOH溶液至过量 | ____ |
(4)含少量NaOH的NaAlO2溶液 | 逐滴加入稀盐酸 | ____ |
【答案】B C A D
【解析】
(1)饱和石灰水中通入过量CO2,发生反应:Ca(OH)2+CO2=CaCO3↓+H2O、CaCO3+CO2+H2O=Ca(HCO3)2,对应图象为B。答案为B。
(2)氯化铝溶液中加入过量氨水,发生反应:AlCl3+3NH3·H2O =Al(OH)3↓+3NH4Cl,对应图象为C。答案为C。
(3) MgCl2、AlCl3的混合液逐滴加入NaOH溶液至过量,发生反应:MgCl2+2NaOH=Mg(OH)2↓+2NaCl、
AlCl3+3NaOH=Al(OH)3↓+2NaCl、Al(OH)3+NaOH=NaAlO2+2H2O,起初生成沉淀,后来沉淀部分溶解,对应图象为A。答案为A。
(4)含少量NaOH的NaAlO2溶液逐滴加入稀盐酸,发生反应:NaOH+HCl=NaCl+H2O、
NaAlO2+HCl+H2O= Al(OH)3↓+NaCl、Al(OH)3+3HCl=AlCl3+3H2O,对应图象为D。答案为D。

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案【题目】测定硫酸铜晶体(CuSO4·xH2O)结晶水含量的实验流程如下:
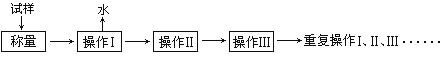
请回答:
(1)以下是实验中可能用到的几种仪器,请在图下方横线上写出仪器名称。
|
|
|
|
a. 电子天平 | b. ___________ | c. ____________ | d. 酒精喷灯 |
①“操作I”是灼烧硫酸铜晶体,将用到上述________(填序号)仪器;
②“操作Ⅱ”是____________,必须在________(填序号)中进行,否则将造成实验测定结果_____________(填“偏高”、“偏低”或“正确”)。
(2) “重复操作Ⅰ、Ⅱ、Ⅲ”,称为恒重操作。判断达到恒重的依据是____________________________________________;进行恒重操作的目的是____________________________________________。
(3)某学生实验后得到下表数据:
加热前质量 | 加热后质量 | |
m1(容器) | m2(容器+晶体) | m3(容器+无水硫酸铜) |
5.4 g | 7.9 g | 6.9 g |
① 由此该学生计算得出该硫酸铜晶体中结晶水x的值为________________(精确到0.1)。
② 指出该同学实验操作或数据处理中存在的主要问题____________(至少写2点)。
【题目】碘酸钙[Ca(IO3)2]广泛用于食品工业、口腔洗涤,防腐等领域,某化学兴趣小组在实验室利用碘在酸性条件下被氯酸钾氧化成碘酸氢钾(KIO3·HIO3),溶液经氢氧化钾中和后,与氯化钙发生复分解反应制备碘酸钙,其制备步骤及装置(水浴加热装置略去)如图: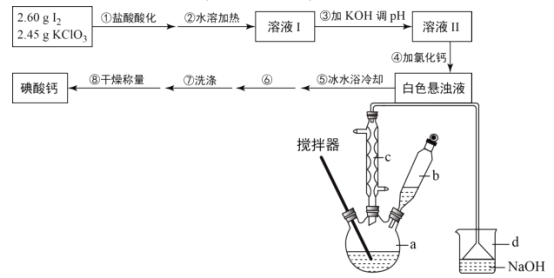
物质的摩尔质量如下表:
物质 | I2 | KClO3 | Ca(IO3)2 |
摩尔质量/g·mol-1 | 354 | 122.5 | 390 |
请回答下列问题:
(1)加入b中盐酸后,碘在酸性条件下被氯酸钾氧化成碘酸氢钾(KIO3·HIO3),反应中有黄绿色的气体生成,该反应的化学方程式为___。
(2)步骤②与“直接加热”相比,“水浴加热”的优点为___。
(3)步骤④加入氯化钙后,得到白色悬浊液,说明KIO3的溶解度___(填“大于”“小于”或“等于”)Ca(IO3)2。
(4)步骤⑤冰水浴冷却的目的为___。
(5)步骤⑥的操作名称为___。
(6)步骤⑦洗涤后检验沉淀是否洗涤干净的方法为___。
(7)最终得到2..60g碘酸钙产品,则产率为___ %(保留2小数)。