��Ŀ����
����Ŀ����һ��������ܱ������У��������»�ѧ��Ӧ��CO2(g)+H2(g)CO(g)+H2O(g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
t�� | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
(1)�÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK= ______
(2)�÷�ӦΪ ______ ��Ӧ(ѡ������������������)��
(3)���жϸ÷�Ӧ�Ƿ�ﵽ��ѧƽ��״̬�������� ______ ��
A��������ѹǿ���� B�����������c(CO)����
C��v��(H2)=v��(H2O) D��c(CO2)=c(CO)
(4)ij�¶��£�ƽ��Ũ�ȷ���c(CO2)c(H2)=c(CO)c(H2O)�����жϴ�ʱ���¶�Ϊ ______ �森�ڴ��¶���2L�ܱ������н��з�ӦCO2(g)+H2(g)CO(g)+H2O(g)��CO2(g)��H2(g)����ʼ����Ϊ2.0mol���ﵽƽ��ʱCO2��ת����Ϊ ______ ��
(5)���ܱ������н��з�Ӧ��Fe(s)+CO2(g)FeO(s)+CO(g)��H1=akJmol-1
��Ӧ��2CO(g)+O2(g)2CO2(g)��H2=b kJmol-1
��Ӧ��2Fe(s)+O2(g)2FeO(s)��H3
���H3= ______ (�ú�a��b�Ĵ���ʽ��ʾ)��
���𰸡�c(CO)c(H2O )/[c(CO2 )c(H2)] ���� BC 830 50% (2a+b)kJ/mol
��������
������������ԭ��������ѧƽ���ƶ��ķ��������𣻸��ݻ�ѧƽ�ⳣ��������������𣻸��ݡ�����ʽ�����㻯ѧƽ����̷������
(1)������Ӧ��ѧƽ�ⳣ���ı���ʽΪ��K=![]() ��
��
�ʴ�Ϊ��K=![]() ��
��
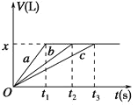
(2)��ͼ������֪�����¶ȵ����ߣ�ƽ�ⳣ������˵������ʱƽ�����ƣ���ˣ��÷�Ӧ�������ȷ�Ӧ��
�ʴ�Ϊ�����ȣ�
(3)ƽ��״̬�ı����������淴Ӧ������ȣ������Ǹ���ֵ�Ũ�ȱ��ֲ��䡣
A.�÷�Ӧ��������������䣬ѹǿҲ�Ͳ��䣬��ˣ�ѹǿ���䲻��˵����Ӧ�Ѵﵽƽ��״̬��
B.һ����̼��Ũ�Ȳ��䣬�����ɷֵ�Ũ��Ҳ����ı䣬˵����Ӧ�ﵽƽ��״̬��
C.v��(H2)=v��(H2O)�����������淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬��
D.c(CO2)=c(CO)��û������Ũ�Ȳ��ٸı䣬����˵����Ӧ�Ѵﵽƽ��״̬��
��ѡ��B��C��
(4)c(CO2)c(H2)=c(CO)c(H2O)����![]() =K=1����Ӧ���¶�Ϊ830����
=K=1����Ӧ���¶�Ϊ830����
�ʴ�Ϊ��830����
���ݷ�Ӧ����ʽ��CO2(g)+H2(g)CO(g)+H2O(g)����ƽ��ʱ��CO2�ı仯��Ϊxmol��
��ʼ״̬ 2mol 2mol 0 0
ƽ��ʱ (2-x)mol (2-x)mol xmol xmol ��֪K=![]() =1���������ɵõ�n(CO2)=n(CO)=1mol�����ﵽƽ��ʱCO2��ת����Ϊ��
=1���������ɵõ�n(CO2)=n(CO)=1mol�����ﵽƽ��ʱCO2��ת����Ϊ��![]() ��100%=50%��
��100%=50%��
�ʴ�Ϊ��50%��
(5)���ݸ�˹���ɣ�2����+�ڿɵõ���Ӧ�ۣ����ԡ�H3=(2a+b)kJ/mol��
�ʴ�Ϊ��(2a+b)kJ/mol��

����Ŀ����Ҫ��ش��������⣺
(1)�״���һ����Ҫ�Ļ���ԭ�ϣ�������Ҫ����;��Ӧ��ǰ������ҵ��һ������������ַ�Ӧ�ϳɼ״���
��ӦI��CO(g)+2H2(g)CH3OH(g)����H1
��ӦII��CO2(g)+3H2(g)CH3OH(g)+H2O(g)����H2
��������Ӧ��ԭ�������ʰٷ�֮�ٵ���______(����I����������)
���±����������Ƿ�ӦI�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ��(K)
�¶� | 250�� | 300�� | 350�� |
K | 2.041 | 0.270 | 0.012 |
�ɱ��������жϡ�H1______0��T��ʱ����2molCO��6molH2����2L���ܱ������У���ַ�Ӧ���ﵽƽ����c(CO)=0.2mol/L����ʱTΪ______��
(2)��֪�ڳ��³�ѹ�£�
��2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)��H1=-1275.6kJ/mol
��2CO(g)+O2(g)=2CO2(g)��H2=-566.0kJ/mol
��H2O(g)=H2O(l)��H3=-44.0kJ/mol
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��______��