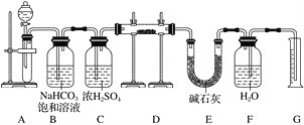
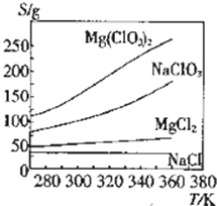
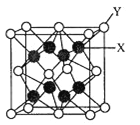
题目内容
【题目】某温度下,体积和pH都相同的NaOH溶液与CH3COONa溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
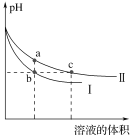
A. c点的溶液中c(OH)+c(CH3COOH)=c(H+)
B. a、b两点溶液的导电性:a>b
C. b、c两点溶液中水的电离程度:b=c
D. 用相同浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸的体积:Vb=Vc
【答案】B
【解析】
NaOH是强碱,而CH3COONa溶液中存在水解平衡,所以相同pH溶液进行稀释时,CH3COONa溶液的pH变化比较平缓,所以曲线II为CH3COONa稀释曲线。
A.任一点溶液中均存在电荷守恒:c(OH)+c(CH3COO-)=c(H+)+c(Na+),依据物料守恒有: c(CH3COO-)+c(CH3COOH)=c(Na+),将两式相减得:c(H+)+c(CH3COOH)=c(OH)。如所给的等式c(OH)+c(CH3COOH)=c(H+)成立,则可得出c(CH3COOH)=0这一错误的结论,A项错误;
B.开始两溶液的pH相同,则开始物质的量浓度:CH3COONa>NaOH,a、b两点溶液稀释的倍数相同,所得对应溶液中的离子浓度:CH3COONa>NaOH,导电性:a>b, B项正确;
C.b、c两点溶液中pH相同,但一个是碱溶液,水的电离受到抑制,一个是强碱弱酸盐的溶液,水的电离因CH3COO-水解而受到促进,所以水的电离程度:b<c, C项错误;
D.盐类的水解是微弱的,所以稀释前NaOH溶液与CH3COONa溶液中溶质的物质的量:n(CH3COONa)>n(NaOH),所以用相同浓度的盐酸分别与等体积的b、c处溶液恰好完全反应时,消耗盐酸的体积:Vb<Vc,D项错误;
所以答案选择B项。

【题目】用O2将HCl转化为Cl2,可提高效益,减少污染,
(1)传统上该转化通过如图所示的催化剂循环实现,

其中,反应①为:2HCl(g) + CuO(s)![]() H2O(g)+CuCl2(g) △H1
H2O(g)+CuCl2(g) △H1
反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为___________(反应热用△H1和△H2表示)。
(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性,
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的aHCl—T曲线如图,则总反应的△H___0(填“>”、“﹦”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是_______。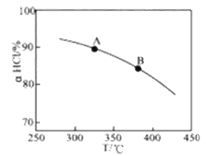
②在上述实验中若压缩体积使压强增大,画出相应aHCl—T曲线的示意图,并简要说明理由______________。
③下列措施中有利于提高aHCl的有___________。
A、增大n(HCl) B、增大n(O2)
C、使用更好的催化剂 D、移去H2O
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
t(min) | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
n(Cl2)/10-3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
计算2.0~6.0min内以HCl的物质的量变化表示的反应速率______(以mol·min-1为单位,写出计算过程)。
(4)Cl2用途广泛,写出用Cl2制备漂白粉的化学方程式______________。