题目内容
11.己知X、Y、Z、W、N、U、V是短周期的主族元素,原子序数依次增大.X与N同主族,且与W都能形成A2B、A2B2型化合物;Z、W的单质常温下均为无色气体;Y原子的L层电子数是K层电子数的2倍;U原子的最外层电子数是其电子层数的2倍,试回答下列问题:(1)YW2的电子式
 ;Z的氢化物结构式为
;Z的氢化物结构式为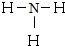 ;写出U元素在周期表中的位置第三周期第VIA族.
;写出U元素在周期表中的位置第三周期第VIA族.(2)离子半径:N+<W2-(填>、<或=);
(3)写出UW2与V元素的单质在水溶液中反应的化学方程式是Cl2+SO2+2H2O=H2SO4+2HCl.
(4)由N、W组成A2B2型的一种化合物,该物质属于离子(填“离子”或“共价”)化合物.
分析 X、Y、Z、W、N、U、V是短周期的主族元素,原子序数依次增大,X与N同主族,且与W都能形成A2B、A2B2型化合物,则X是H、N是Na、W是O元素;
Z、W的单质常温下均为无色气体,且Z原子序数小于W,则Z是N元素;
Y原子的L层电子数是K层电子数的2倍,则Y为C元素;
U原子的最外层电子数是其电子层数的2倍,原子序数大于N,为第三周期元素,所以U为S元素,这几种元素都是短周期主族元素,所以V是Cl元素,
(1)CO2是共价化合物,每个O原子和C原子形成两个共用电子对;
N的氢化物为NH3,氨气分子中每个H原子和N原子形成一个共价键;
主族元素原子电子层数与其周期数相等、最外层电子数与其族序数相等;
(2)电子层结构相同的离子,离子半径随着原子序数增大而减小;
(3)氯气具有强氧化性,二氧化硫具有还原性,二者发生氧化还原反应生成硫酸和盐酸;
(4)由N、W组成A2B2型的一种化合物为Na2O2,含有离子键的化合物属于离子化合物.
解答 解:X、Y、Z、W、N、U、V是短周期的主族元素,原子序数依次增大,X与N同主族,且与W都能形成A2B、A2B2型化合物,则X是H、N是Na、W是O元素;
Z、W的单质常温下均为无色气体,且Z原子序数小于W,则Z是N元素;
Y原子的L层电子数是K层电子数的2倍,则Y为C元素;
U原子的最外层电子数是其电子层数的2倍,原子序数大于N,为第三周期元素,所以U为S元素,这几种元素都是短周期主族元素,所以V是Cl元素,
(1)CO2是共价化合物,每个O原子和C原子形成两个共用电子对,其电子式为 ;
;
N的氢化物为NH3,氨气分子中每个H原子和N原子形成一个共价键,其结构式为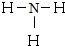 ;
;
主族元素原子电子层数与其周期数相等、最外层电子数与其族序数相等,S原子核外有3个电子层、最外层电子数是6,位于第三周期第VIA族,
故答案为: ;
;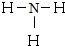 ;第三周期第VIA族;
;第三周期第VIA族;
(2)电子层结构相同的离子,离子半径随着原子序数增大而减小,钠离子和氧离子电子层结构相同,原子序数Na>O,所以离子半径:Na+<O2-,故答案为:<;
(3)氯气具有强氧化性,二氧化硫具有还原性,二者发生氧化还原反应生成硫酸和盐酸,反应方程式为
Cl2+SO2+2H2O=H2SO4+2HCl,故答案为:Cl2+SO2+2H2O=H2SO4+2HCl;
(4)由N、W组成A2B2型的一种化合物为Na2O2,过氧化钠中钠离子和过氧根离子之间存在离子键、O-O原子之间存在共价键,所以属于离子化合物,故答案为:离子.
点评 本题考查位置结构性质的相互关系及应用,涉及物质结构、分子结构、物质性质等知识点,熟练掌握物质的构成微粒、元素周期律、物质性质等,知道化合物与化学键的关系,题目难度不大.

| A. | C的质量分数降低 | B. | 平衡向右移动 | C. | B的转化率升高 | D. | x+y<z |
| A. | 1mol/L Na2CO3溶液中的Na+数目为2NA | |
| B. | 1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA电子 | |
| C. | 标准状况下,11.2LSO3所含分子数为0.5NA | |
| D. | 各5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA |
| A. | 丙烷的分子式是C3H6 | |
| B. | 丙烷分子中的碳原子在一条直线上 | |
| C. | 丙烷在光照条件下能够和氯气发生加成反应 | |
| D. | 丙烷的熔点比乙烷高 |
| A. | N2 | B. | CO2 | C. | BF3 | D. | PCl3 |
| A. | 铁 | B. | 氧 | C. | 钾 | D. | 钙 |
| A. | 干水属于有机合成材料 | |
| B. | 干水中的水分子停止运动 | |
| C. | 干水是一种混合物 | |
| D. | 干水吸收CO2的过程只发生物理变化 |
| A. | R一定是共价化合物 | |
| B. | R一定是离子化合物 | |
| C. | R可能是共价化合物,也可能是离子化合物 | |
| D. | R是气态物质 |

 .
.