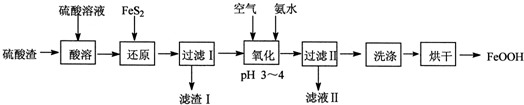
题目内容
19.下列叙述不正确的是( )| A. | 1.68g铁粉发生吸氧腐蚀时,理论上最多能吸收氧气504mL(标准状况) | |
| B. | 镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易被腐蚀 | |
| C. | 为保护海轮的船壳,常在船壳外面镶上锌块 | |
| D. | 化学电源的能量来源于氧化还原反应所释放的化学能 |
分析 A、根据正负极上得失电子数守恒来计算;
B、锌较活泼,镀锌铁难以腐蚀,原电池的正极金属被保护;
C、在船壳外面镶上锌块,形成的原电池中,金属锌是负极,铁是正极;
D、原电池为化学能转化为电能的装置.
解答 解:A、吸氧腐蚀的负极反应:Fe-2e-=Fe2+,正极反应:2H2O+O2+4e→4OH-,故可知铁与氧气的量的关系:2Fe~O2,故1.68g铁即0.03mol铁反应时,消耗0.015mol氧气,标况下为504mL,故A正确;
B、锌较活泼,镀锌铁难以腐蚀,而铁比锡活泼,镀锡铁更易被腐蚀,故B错误;
C、在船壳外面镶上锌块,形成的原电池中,金属锌是负极,铁是正极,正极上的金属被保护,这样锌可以保护海轮的船壳,故C正确;
D、原电池为化学能转化为电能的装置,即化学电源的能量来源于氧化还原反应所释放的化学能,故D正确.
故选B.
点评 本题考查金属的腐蚀以及防护,为高频考点,侧重于学生的分析能力和基本理论知识的综合理解与运用的考查,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
7.已知下列元素的原子半径:
根据以上数据,磷元素的原子半径可能是( )
| 元素 | N | S | O | Si |
| 原子半径/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
| A. | 0.80×10-10m | B. | 0.70×10-10m | C. | 1.20×10-10m | D. | 1.10×10-10m |
14.以铅蓄电池为电源电解强酸性的CO2水溶液可以得到丙烯,a和b为特殊惰性电极,原理如甲、乙两图所示.下列有关说法正确的是( )
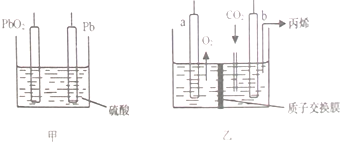

| A. | 为实现工作原理,PbO2电极应与b电极相连 | |
| B. | b电极反应式为:3CO2+18e-+18H+=6H2O+CH3CH=CH2 | |
| C. | 在铅蓄电池供电过程中,Pb电极质量不断减小 | |
| D. | 乙装置中H+由b电极向a电极移动 |
4.若要产生一定量的氯气,下列物质分别与足量浓盐酸反应,消耗的物质的量最少的是( )
| A. | KMnO4 | B. | KClO3 | C. | MnO2 | D. | Ca(ClO)2 |
8.在测定中和热的实验中,下列说法正确的是( )
| A. | 使用环形玻璃搅拌棒是为了加快反应速率,使其充分反应,减小实验误差 | |
| B. | 为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触 | |
| C. | 为了使反应均匀进行,可以向酸(碱)中分次加入碱(酸) | |
| D. | 在测定中和热实验中需要使用的仪器有量筒、烧杯、胶头滴管、温度计等 |
 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和反应的反应热.
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和反应的反应热.