题目内容
11.利用硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)生产铁基颜料铁黄(FeOOH)的制备流程如下: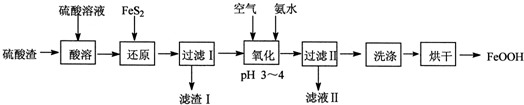
(1)“酸溶”时,Fe2O3与硫酸反应的化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O.
(2)滤渣Ⅰ的主要成分是FeS2、S和SiO2(填化学式);Fe3+被FeS2还原的离子方程式为2Fe3++FeS2=3Fe2++2S.
(3)“氧化”中,生成FeOOH的离子方程式为4Fe2++8NH3•H2O+O2=4FeOOH↓+8NH4++2H2O.
(4)滤液Ⅱ中溶质是Al2(SO4)3和(NH4)2SO4(填化学式);“洗涤”时,检验铁黄表面已洗涤干净的操作是取最后一次洗涤液,滴加盐酸酸化的BaCl2溶液,若无白色沉淀说明已洗干净.
分析 硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)加硫酸溶解,金属氧化物转化为金属阳离子,二氧化硅不溶,再加FeS2把铁离子还原为Fe2+,同时生成S沉淀,过滤,滤渣含有二氧化硅和S、FeS2,滤液中含有Fe2+和Al3+,滤液中通入空气氧化,同时调节pH生成FeOOH沉淀,过滤、洗涤、烘干,得到纯净的FeOOH;
(1)氧化铁是碱性氧化物,可以和酸反应生成盐和水;
(2)根据流程分析判断;由反应物和生成物以及电子守恒来配平化学方程式;
(3)在碱性环境下,亚铁离子可以被氧气氧化为生成FeOOH;
(4)加氨水调节pH时,生成了硫酸铵;铁黄表面附着的离子为硫酸根离子,若洗液中没有硫酸根离子,说明已经洗净,根据检验硫酸根离子的方法分析.
解答 解:硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)加硫酸溶解,金属氧化物转化为金属阳离子,二氧化硅不溶,再加FeS2把铁离子还原为Fe2+,同时生成S沉淀,过滤,滤渣含有二氧化硅和S、FeS2,滤液中含有Fe2+和Al3+,滤液中通入空气氧化,同时调节pH生成FeOOH沉淀,过滤、洗涤、烘干,得到纯净的FeOOH;
(1)氧化铁是碱性氧化物,可以和硫酸反应生成硫酸铁和水,即Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,
故答案为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(2)由流程分析可知滤渣Ⅰ的主要成分是FeS2、S和SiO2;-2价的硫离子具有还原性,FeS2可以将溶液中的Fe3+还原为Fe2+,而本身被氧化为S沉淀,有关的离子方程式为2Fe3++FeS2=3Fe2++2S,
故答案为:SiO2;2Fe3++FeS2=3Fe2++2S;
(3)在碱性环境下,亚铁离子可以被氧气氧化为生成FeOOH,则“氧化”中,亚铁离子、氧气及氨水反应生成FeOOH、铵根离子和水,其离子方程式为4Fe2++8NH3•H2O+O2=4FeOOH↓+8NH4++2H2O,
故答案为:4Fe2++8NH3•H2O+O2=4FeOOH↓+8NH4++2H2O;
(4)滤液I中加氨水调节pH,会生成硫酸铵,所以滤液Ⅱ中溶质是Al2(SO4)3和 (NH4)2SO4;
铁黄表面附着的离子为硫酸根离子,若洗液中没有硫酸根离子,说明已经洗净,则其操作为取最后一次洗涤液,滴加盐酸酸化的BaCl2溶液,若无白色沉淀说明已洗干净.
故答案为:(NH4)2SO4;取最后一次洗涤液,滴加盐酸酸化的BaCl2溶液,若无白色沉淀说明已洗干净.
点评 本题以铁黄(FeOOH)的制备流程为知识背景,考查硅、铁的化合物的性质、离子方程式的书写、物质的分离提纯等,难度中等,清楚工艺流程原理是解题的关键,是对知识迁移的综合运用.

 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案| A. | 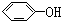 与 与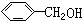 | B. | CH4与C3H8 | ||
| C. | 乙二醇和丙三醇 | D. | CH3CH=CHCH3 和CH2=C(CH3)2 |
 新型NaBH4-H2O2燃料电池(DBFC)的结构如图所示(已知NaBH4中氢为-1价),有关该电池的说法不正确的是( )
新型NaBH4-H2O2燃料电池(DBFC)的结构如图所示(已知NaBH4中氢为-1价),有关该电池的说法不正确的是( )| A. | 放电过程中Na+从A极区向B极区迁移 | |
| B. | 电极B材料中含MnO2层,MnO2起导电作用 | |
| C. | 在电池反应中,每消耗1 L 6 mol•L-1H2O2溶液,理论上流过电路中的电子为12 个NA | |
| D. | 电池负极区的电极反应为BH4-+8OH--8e-=BO2+6H2O |
| A. | 1.68g铁粉发生吸氧腐蚀时,理论上最多能吸收氧气504mL(标准状况) | |
| B. | 镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易被腐蚀 | |
| C. | 为保护海轮的船壳,常在船壳外面镶上锌块 | |
| D. | 化学电源的能量来源于氧化还原反应所释放的化学能 |
 的下列说法中正确的是( )
的下列说法中正确的是( )| A. | 分子式为C9H9O2 | |
| B. | 含有三种官能团 | |
| C. | 可使溴的四氯化碳溶液或酸性KMnO4溶液褪色 | |
| D. | 可以发生取代反应和加成反应,但不能发生聚合反应 |
| A. | 向盛有少量Mg(OH)2沉淀的试管中滴加适量NH4Cl溶液,沉淀溶解:Mg(OH)2+2NH4+=2NH3•H2O+Mg2+ | |
| B. | SO2通入澄清石灰水中,产生白色沉淀:SO2+Ca2++2OH-=CaSO4↓+H2O | |
| C. | 向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 长期过量服用阿司匹林出现水杨酸(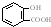 )反应,可静脉注滴NaHCO3溶液: )反应,可静脉注滴NaHCO3溶液: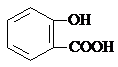 +HCO3-→ +HCO3-→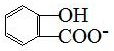 +CO2↑+H2O +CO2↑+H2O |
| A. | 卤素单质Cl2、Br2、I2的氧化性 | |
| B. | 气态氢化物NH3、H2O、HF的稳定性 | |
| C. | 碱金属单质Li、Na、K与水反应的剧烈程度 | |
| D. | 1mol Na、Mg、Al分别与足量盐酸反应时失电子数的多少 |
| A. | SO2可用作漂白剂,原因是具有还原性 | |
| B. | FeCl3溶液可用于制印刷电路板,原因是能氧化Cu | |
| C. | Cl2可制漂白粉,原因是能与NaOH反应 | |
| D. | Al(OH)3可用于治疗胃酸过多,原因是碱性强 |
| A. | 平行光照射胶体产生丁达尔现象 | B. | 紫外线照射下,液态蛋白质凝固 | ||
| C. | 电解质溶液导电过程 | D. | 铁遇到冷的浓硝酸溶液发生钝化 |