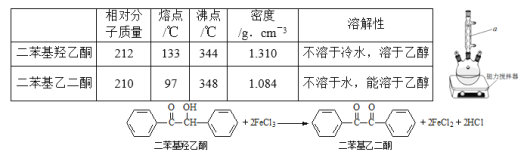
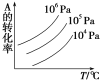
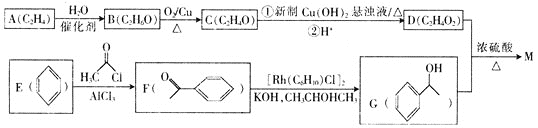
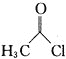
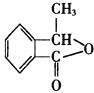
题目内容
【题目】有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复) 提示:CH3COONH4溶液为中性
阳离子 | Na+、Ba2+、NH4+ |
阴离子 | CH3COO-、Cl-、OH-、SO42- |
已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)A是______ ,B是_______ 。
(2)25℃时,0.1mol·L-1B溶液的pH=a,则B溶液中c(H+)-c(NH3·H2O)= _______(用含a的关系式表示)。
(3)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为__________________。
(4)在一定体积0.005 mol·L-1的C溶液中,加入一定体积的0.00125 mol·L-1的盐酸时,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是 ____________。
【答案】CH3COONa NH4Cl 1×10(a-14)mol/L c(OH-)> c(Ba2+) = c(Cl-)> c(NH4+)> c(H+) 1:4
【解析】
①A、C溶液的pH均大于7,应为醋酸盐和碱的溶液,A、B的溶液中水的电离程度相同,则溶液中水解程度相同;
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象,说明C为氢氧化钡,D为硫酸钠,B为氯化铵,A为醋酸钠。
(1)根据上述分析知道A为CH3COONa,B为NH4Cl;
(2)在氯化铵中存在电荷守恒c(OH-)+= c(Cl-)= c(NH4+)+ c(H+),原子守恒, c(Cl-)= c(NH4+)+ c(NH3·H2O),根据两个等式可以得出c(H+)-c(NH3·H2O)=c(OH-)=1×10(a-14)mol/L;
(3)等体积等物质的量浓度的氯化铵和氢氧化钡婚反应后溶质是氯化钡和氢氧化钡和一水合氨,则有c(OH-)> c(Ba2+) = c(Cl-)> c(NH4+)> c(H+);
(4)混合溶液的pH=11,则溶液中氢氧根离子浓度为10-3mol/L,设氢氧化钠的体积为x,盐酸的体积为y,则有c(OH-)= ![]() =10-3,解x:y=1:4。
=10-3,解x:y=1:4。

【题目】中和滴定是高中化学重要的定量实验。请回答下列问题:
(1)用标准盐酸滴定未知浓度的NaOH溶液,下列情况会造成测定结果偏高的是________(填选项字母)。
A.滴定终点读数时,俯视滴定管刻度
B.盛装NaOH溶液的锥形瓶用蒸馏水洗过,未用NaOH溶液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失
(2)取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.02 mol·L-1的高锰酸钾溶液滴定,发生反应的离子方程式为:_________________
(3)滴定数据如下:
滴定次数 | 待测液体积(mL) | 标准KMnO4溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 3.00 | 23.40 |
第三次 | 25.00 | 4.00 | 24.10 |
①滴定时,该反应速率开始十分缓慢,一段时间后突然加快,这是因为_________(填离子)对该反应具有催化作用,KMnO4溶液应装在_____(填“酸”或“碱”)式滴定管中;滴定终点的现象是_____________________。
②该草酸溶液的物质的量浓度为____________。
【题目】某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体______g。
(2)从下表中选择称量NaOH固体所需要的仪器是(填字母):____。
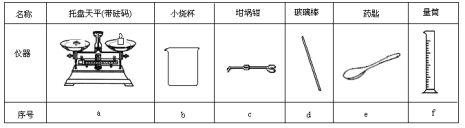
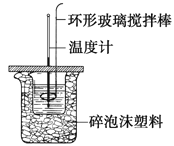
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
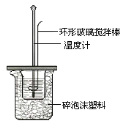
(1)写出该反应的热化学方程式(中和热为57.3kJ/mol):_____。
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
温度 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | _____ |
2 | 27.0 | 27.4 | 27.2 | 31.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热△H=___(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度