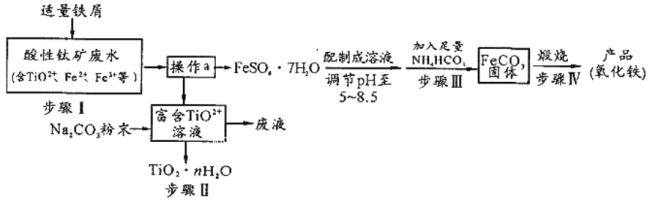
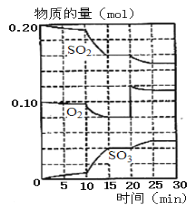
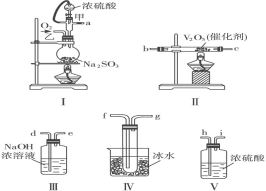
题目内容
【题目】二苯基乙二酮常用作医药中间体及紫外线固化剂,可由二苯基羟乙酮氧化制得,相关物质的物理参数、化学方程式及装置图(加热和夹持装置已略去)如下:
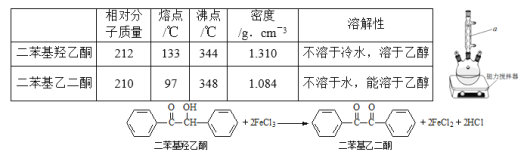
在反应装置中,加入10ml冰醋酸、5.50gFeCl3固体、10ml水及少量碎瓷片,加热至沸腾,停止加热,待沸腾平息后加入2.12g二苯基羟乙酮,继续加热回流至二苯基羟乙酮完全反应。反应结束后加水煮沸,冷却后即有二苯基乙二酮粗产品析出,用70%乙醇水溶液重结晶提纯,得到1.80g产品。
重结晶过程如下:
加热溶解→活性炭脱色→趁热过滤 →冷却结晶→抽滤→洗涤→干燥
请回答以下问题:
(1)装置图中仪器a的名称是_______________,其作用是______________。
(2)加入碎瓷片的作用是________。若加热后发现未加碎瓷片,应采取的正确方法是____________________________________________________。
(3)实验中可采用薄层色谱跟踪反应进程,其原理和操作与纸上层析类同,通过观察薄层色谱展开后的斑点(在实验条件下,只有二苯基羟乙酮和二苯基乙二酮能够产生斑点)判断样品中的成分。下图分别为加入二苯基羟乙酮后反应开始、回流15min、30min、45min和60min时,用毛细管取样、点样,薄层色谱展开后的斑点:
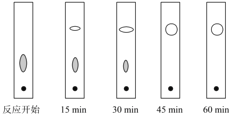
该实验条件下加热________后可认为反应结束。
A.15min B.30min C.45min D.60min
(4)上述重结晶过程中,____________(填步骤名称)操作除去了不溶性杂质。
(5)在重结晶过程中,不可选用明火直接加热,原因是_________________________。
(6)不选择蒸馏的方法提纯二苯基乙二酮粗产品的原因是______________________。
(7)本实验的产率是_________%。(保留3位有效数字)
【答案】冷凝管 冷凝回流 防止暴沸 停止加热,待冷却后补加 C 趁热过滤 所用70%乙醇溶液会挥发出乙醇蒸气,与空气混合遇明火爆炸 二苯基乙二酮粗产品为固体混合物,二苯基乙二酮与二苯基羟乙酮的沸点差别较小 85.7
【解析】
(1)根据装置图确定仪器a的名称及作用;
(2)蒸馏装置中加入碎瓷片可防止暴沸;若加热后发现未加碎瓷片,要将装置冷却至室温后再补加碎瓷片;
(3)由色谱的斑点可知,45min和60min的斑点一致,由此进行判断;
(4)重结晶的过程为加热溶解,趁热过滤,冷却结晶,其中除去不溶性杂质可趁热过滤;
(5)乙醇易挥发,蒸气与空气混合后遇明火爆炸;
(6)二苯基乙二酮粗产品中含有二苯基羟二酮,二者的沸点分别为344℃、348℃,沸点差异过小,不能使用蒸馏的方法分离提纯;
(7)2.12g二苯基羟乙酮物质的量为0.01mol,1.80g二苯基乙二酮物质的量为![]() =0.008574mol,可进一步计算产率。
=0.008574mol,可进一步计算产率。
(1)装置图中仪器a的名称是冷凝管,其作用是使蒸气冷凝回流,继续反应;
(2)加入碎瓷片的作用为防暴沸,若加热后发现未加碎瓷片,应该采取的操作为停止加热,待冷却后补加;
(3)45min和60min的斑点一致,则在45min时,反应已经结束;答案选C;
(4)重结晶过程中获得产品为二苯基乙二酮,含有的杂质为二苯基羟乙酮,二苯基羟乙酮不溶于冷水,则应该趁热过滤;
(5)提纯二苯基乙二酮粗产品,所用70%乙醇溶液会挥发出乙醇蒸气,与空气混合遇明火爆炸,因此不能选用明火加热;
(6)不选择蒸馏的方法提纯二苯基乙二酮粗产品的原因是二苯基乙二酮粗产品为固体混合物,二苯基乙二酮与二苯基羟乙酮的沸点差别较小;
(7)2.12g二苯基羟乙酮物质的量为0.01mol,1.80g二苯基乙二酮物质的量为![]() =0.008574mol,则产率为
=0.008574mol,则产率为![]() ×100%=85.7%。
×100%=85.7%。

 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
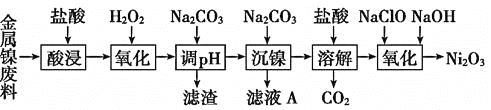
津桥教育暑假拔高衔接广东人民出版社系列答案【题目】三氧化二镍![]() 是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料
是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料![]() 含有少量的铁、铝等杂质
含有少量的铁、铝等杂质![]() ,继而生产
,继而生产![]() 的工艺流程如下:
的工艺流程如下:
下表列出了相关金属离子生成氢氧化物沉淀的![]() 开始沉淀的pH按金属离子浓度为
开始沉淀的pH按金属离子浓度为![]() 计算
计算![]() 。
。
氢氧化物 |
|
|
|
|
开始沉淀的pH |
|
|
|
|
沉淀完全的pH |
|
|
|
|
(1)为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有______
A. 降低温度 ![]() 搅拌
搅拌 ![]() 减少盐酸的浓度
减少盐酸的浓度 ![]() 将废料研成粉末
将废料研成粉末
(2)酸浸后的酸性溶液中加入![]() 的目的:__________。沉镍前需加
的目的:__________。沉镍前需加![]() 控制溶液pH范围为______,所得到滤渣的主要成分是_______。
控制溶液pH范围为______,所得到滤渣的主要成分是_______。
(3)从滤液A中可回收利用的主要物质是![]() 和________。
和________。
(4)“氧化”生成![]() 的离子方程式为__________________________。
的离子方程式为__________________________。
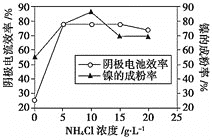
(5)工业上用镍为阳极,电解![]() 溶液与一定量
溶液与一定量![]() 组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,
组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,![]() 的浓度对阴极电流效率及镍的成粉率的影响如图所示,则
的浓度对阴极电流效率及镍的成粉率的影响如图所示,则![]() 的浓度最好控制为_________。
的浓度最好控制为_________。
【题目】Na、Al、Fe、Cu是中学化学中重要的金属元素。它们的单质及其化合物之间有很多转化关系。下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是
选项 | A | B | C | D |
|
a | Na | Al | Fe | Cu | |
b | NaOH | Al2O3 | FeCl3 | CuO | |
c | NaCl | Al(OH)3 | FeCl2 | CuCl2 |
A.AB.BC.CD.D
【题目】有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复) 提示:CH3COONH4溶液为中性
阳离子 | Na+、Ba2+、NH4+ |
阴离子 | CH3COO-、Cl-、OH-、SO42- |
已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)A是______ ,B是_______ 。
(2)25℃时,0.1mol·L-1B溶液的pH=a,则B溶液中c(H+)-c(NH3·H2O)= _______(用含a的关系式表示)。
(3)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为__________________。
(4)在一定体积0.005 mol·L-1的C溶液中,加入一定体积的0.00125 mol·L-1的盐酸时,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是 ____________。