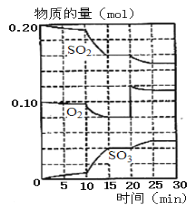
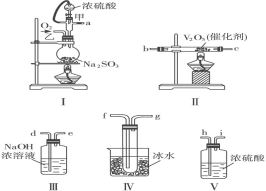
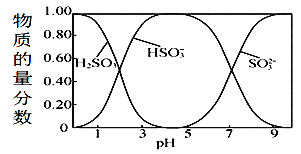
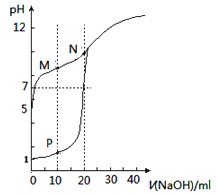
题目内容
【题目】对于溶液的酸碱性说法正确的是
A.含OH-的溶液一定呈碱性B.在100°C时,纯水的pH<7,因此显酸性
C.c(H+)=c(OH-)的溶液一定呈中性D.pH=14的溶液碱性最强
【答案】C
【解析】
A、水存在电离:H2O![]() H++OH-,有水的存在时,溶液中一定存在OH-,但溶液不一定是碱性,溶液呈碱性的判断依据是c(OH-)>c(H+),故A错误;
H++OH-,有水的存在时,溶液中一定存在OH-,但溶液不一定是碱性,溶液呈碱性的判断依据是c(OH-)>c(H+),故A错误;
B、在100℃时,纯水中存在c(OH-)=c(H+),仍然呈中性,其pH=6,故B错误;
C、任何水溶液中只要存在c(OH-)=c(H+),则该溶液一定呈中性,故C正确;
D、pH表示溶液酸碱性的适用范围为:c(H+)<1mol/L或c(OH-)<1mol/L,当溶液中c(OH-)或c(H+)大于1mol/L,可直接用c(OH-)或c(H+)表示酸碱性,在25℃下,pH=14的溶液中c(OH-)=1mol/L,其碱性小于c(OH-)>1mol/L的溶液,且用pH表示溶液的碱性时,需要溶液的温度,而题干温度未知,故不能根据pH大小判断溶液酸碱性,故D错误;
故答案为C。

【题目】有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复) 提示:CH3COONH4溶液为中性
阳离子 | Na+、Ba2+、NH4+ |
阴离子 | CH3COO-、Cl-、OH-、SO42- |
已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)A是______ ,B是_______ 。
(2)25℃时,0.1mol·L-1B溶液的pH=a,则B溶液中c(H+)-c(NH3·H2O)= _______(用含a的关系式表示)。
(3)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为__________________。
(4)在一定体积0.005 mol·L-1的C溶液中,加入一定体积的0.00125 mol·L-1的盐酸时,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是 ____________。