题目内容
8.下列反应既属于氧化还原反应,又是吸热反应的是( )| A. | 锌粒与稀硫酸的反应 | |
| B. | 灼热的氧化铜与CO的反应 | |
| C. | 甲烷在空气中燃烧的反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
分析 存在元素的化合价变化的反应为氧化还原反应,常见的吸热反应有:Ba(OH)2•8H2O与NH4Cl反应、大多数的分解反应、C(或氢气)参加的氧化还原反应等,以此来解答.
解答 解:A.为放热反应,Zn、H元素化合价发生变化,属于氧化还原反应,故A错误;
B.Cu和C元素化合价发生变化,属于氧化还原反应,为吸热反应,故B正确;
C.甲烷的燃烧为放热反应,故C错误;
D.元素化合价没有发生变化,不是氧化还原反应,故D错误.
故选B.
点评 本题考查氧化还原反应,为高考高频考点,侧重反应类型判断的考查,注意化合价角度及归纳常见的吸热反应分析,题目难度不大.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
4. 某汽车尾气分析仪以燃料电池为工作原理测定CO的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法不正确的是( )
某汽车尾气分析仪以燃料电池为工作原理测定CO的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法不正确的是( )
 某汽车尾气分析仪以燃料电池为工作原理测定CO的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法不正确的是( )
某汽车尾气分析仪以燃料电池为工作原理测定CO的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法不正确的是( )| A. | 工作时电极b作正极,O2-由电极b流向电极a | |
| B. | 负极的电极反应式为:CO+O2--2e-═CO2 | |
| C. | 当传感器中通过2×10-3 mol电子时,通过的尾气中含有2.24 mL CO | |
| D. | 传感器中通过的电流越大,尾气中CO的含量越高 |
19.为研究SO2气体的性质,某小组设计完成如图实验.
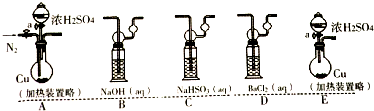
(Ⅰ)将适量纯的SO2气体通入到下列溶液中产生现象如下:
(1)实验②中通入一段时间后才渐渐产生黄色沉淀,表现SO2的氧化性和水溶液酸性;实验⑤中反应的离子方程式为2S2-+5SO2+2H2O=3S↓+4HSO3-;
(Ⅱ)某小组探究铜与浓硫酸反应的产物.将铜与浓硫酸在烧瓶中共热时,液面上产生大量白雾,铜表面先变黑后渐渐溶解;产生的气体依次通过品红溶液和BaCl2溶液,品红溶液褪色,却意外发现BaCl2溶液也能产生白色沉淀;反应所得灰绿色溶液下沉积少量白色固体,倾倒出液体后的白色固体小心加水,溶解后溶液呈蓝色.
【查阅资料】:①Cu2S不溶于稀硫酸,能够溶于热的稀硝酸中,且产生SO42-离子.
②98.3%浓硫酸的沸点:339℃;纯硫酸温度高于500℃部分分解;
(2)对产生的气体通入使BaCl2溶液产生沉淀原因做出猜想并设计实验加以验证.
(a)若考虑装置中的空气中某成分作用于SO2使之产生沉淀,为消除这一因素,装置的选择与连接顺序为CAD;(选给定3个装置,见如图)
(b)利用所设计的装置进行实验依然发现BaCl2溶液产生沉淀,则可能的原因是浓硫酸分解生成二氧化硫和氧气,则排除此因素,装置选择和连接顺序为ACD;(给定装置,如图)
(3)探究上述实验过程中铜表面产生的黑色固体组成,某同学猜想可能为CuO或Cu2S的一种,将不溶解的表面有黑色物质附着的铜滤出、清洗、干燥、磨碎.
下列实验设计能够确认上述同学猜想的是( )
A、取少量样品加入稀硝酸加热观察是否溶解,试管口是否有气体变浅棕色;
B、取少量样品加入稀硫酸充分振荡,观察溶液是否变蓝色;
C、取少量样品加入足量稀硝酸加热溶解,加入BaCl2检验SO42-离子是否产生.
(4)取上述反应的烧瓶中残留物制备CuSO4•5H2O晶体,残留物去除不溶物后中缓缓加入适量水,溶解、蒸发浓缩、冷却结晶、过滤洗涤、干燥称重得该晶体.

(Ⅰ)将适量纯的SO2气体通入到下列溶液中产生现象如下:
| 溶液 | ①品红溶液 | ②Na2S | ③BaCl2 | ④Ba(OH)2 | ⑤Ba(NO3)2 |
| 现象 | 溶液褪色 | 黄色沉淀 | 无明显现象 | 白色沉淀 | 白色沉淀 |
(Ⅱ)某小组探究铜与浓硫酸反应的产物.将铜与浓硫酸在烧瓶中共热时,液面上产生大量白雾,铜表面先变黑后渐渐溶解;产生的气体依次通过品红溶液和BaCl2溶液,品红溶液褪色,却意外发现BaCl2溶液也能产生白色沉淀;反应所得灰绿色溶液下沉积少量白色固体,倾倒出液体后的白色固体小心加水,溶解后溶液呈蓝色.
【查阅资料】:①Cu2S不溶于稀硫酸,能够溶于热的稀硝酸中,且产生SO42-离子.
②98.3%浓硫酸的沸点:339℃;纯硫酸温度高于500℃部分分解;
(2)对产生的气体通入使BaCl2溶液产生沉淀原因做出猜想并设计实验加以验证.
(a)若考虑装置中的空气中某成分作用于SO2使之产生沉淀,为消除这一因素,装置的选择与连接顺序为CAD;(选给定3个装置,见如图)
(b)利用所设计的装置进行实验依然发现BaCl2溶液产生沉淀,则可能的原因是浓硫酸分解生成二氧化硫和氧气,则排除此因素,装置选择和连接顺序为ACD;(给定装置,如图)
(3)探究上述实验过程中铜表面产生的黑色固体组成,某同学猜想可能为CuO或Cu2S的一种,将不溶解的表面有黑色物质附着的铜滤出、清洗、干燥、磨碎.
下列实验设计能够确认上述同学猜想的是( )
A、取少量样品加入稀硝酸加热观察是否溶解,试管口是否有气体变浅棕色;
B、取少量样品加入稀硫酸充分振荡,观察溶液是否变蓝色;
C、取少量样品加入足量稀硝酸加热溶解,加入BaCl2检验SO42-离子是否产生.
(4)取上述反应的烧瓶中残留物制备CuSO4•5H2O晶体,残留物去除不溶物后中缓缓加入适量水,溶解、蒸发浓缩、冷却结晶、过滤洗涤、干燥称重得该晶体.
16.关于金属冶炼的叙述正确的是( )
| A. | 工业上可利用铝热反应大量冶炼金属铁 | |
| B. | 金属钠、铝和铜都可用还原法制备 | |
| C. | 电解饱和氯化镁溶液可得金属镁 | |
| D. | 用足量CO还原磁铁矿得到9 mol铁时转移24 mol电子 |
3.下列化学方程式中,不能用离子方程式H++OH-=H2O表示的是( )
| A. | 2NaOH+H2SO4=NaSO4+2H2O | B. | Ba(OH)2+2 HCl=BaCl2+2H2O | ||
| C. | Ba(OH)2+H2SO4=BaSO4↓+2H2O | D. | Na2CO3+H2SO4=Na2SO4+2H2O+CO2↑ |
20.欲除去甲烷中混有的少量乙烯气体,可以通过装有下列哪种试剂的洗气瓶( )
| A. | 氢氧化钠溶液 | B. | 极稀的溴水 | ||
| C. | 酸性高锰酸钾溶液 | D. | 水 |
18. 瑞典皇家科学院2010年10月5日宣布,将2010年诺贝尔物理学奖授予荷兰籍物理学家安德烈•海姆和拥有英国与俄罗斯双重国籍的物理学家康斯坦丁•诺沃肖洛夫,以表彰他们在石墨烯材料方面的卓越研究.石墨烯结构如下图.它不仅是已知材料中最薄的一种,还非常牢固坚硬;作为单质,它在室温下传递电子的速度比已知导体都快.下列有关石墨烯的说法正确的是( )
瑞典皇家科学院2010年10月5日宣布,将2010年诺贝尔物理学奖授予荷兰籍物理学家安德烈•海姆和拥有英国与俄罗斯双重国籍的物理学家康斯坦丁•诺沃肖洛夫,以表彰他们在石墨烯材料方面的卓越研究.石墨烯结构如下图.它不仅是已知材料中最薄的一种,还非常牢固坚硬;作为单质,它在室温下传递电子的速度比已知导体都快.下列有关石墨烯的说法正确的是( )
 瑞典皇家科学院2010年10月5日宣布,将2010年诺贝尔物理学奖授予荷兰籍物理学家安德烈•海姆和拥有英国与俄罗斯双重国籍的物理学家康斯坦丁•诺沃肖洛夫,以表彰他们在石墨烯材料方面的卓越研究.石墨烯结构如下图.它不仅是已知材料中最薄的一种,还非常牢固坚硬;作为单质,它在室温下传递电子的速度比已知导体都快.下列有关石墨烯的说法正确的是( )
瑞典皇家科学院2010年10月5日宣布,将2010年诺贝尔物理学奖授予荷兰籍物理学家安德烈•海姆和拥有英国与俄罗斯双重国籍的物理学家康斯坦丁•诺沃肖洛夫,以表彰他们在石墨烯材料方面的卓越研究.石墨烯结构如下图.它不仅是已知材料中最薄的一种,还非常牢固坚硬;作为单质,它在室温下传递电子的速度比已知导体都快.下列有关石墨烯的说法正确的是( )| A. | 石墨烯和石墨燃烧都生成二氧化碳,说明它们互为同分异构体 | |
| B. | 石墨烯一定条件下可与氢气发生反应生成石墨烷 | |
| C. | 石墨烯在室温下传递电子的速度快是因为碳原子间以极性键结合 | |
| D. | 12g石墨烯中含有NA个六元碳环 |