题目内容
13.由C、H、O三种元素组成的某有机物,其对空气的相对密度为1.52,现使6.6g该有机物充分燃烧得到的产物全部被碱石灰吸收,碱石灰增重18.6g,经分析得知,碱石灰吸收的CO2和H2O的物质的量相等,求该有机物的分子式.分析 相对密度与相对分子质量成正比,空气的平均分子量为29,据此计算出该有机物的分子量;碱石灰增重的质量为二氧化碳和水的质量,由于CO2和H2O的物质的量相等,结合二者总质量列式计算出其物质的量,再利用质量守恒定律计算出其分子中含有的C、H原子数,最后计算出含有O原子数即可.
解答 解:空气的平均分子量为29,该有机物对空气的相对密度为1.52,则该有机物的分子量为:29×1.52≈44,
6.6g该有机物的物质的量为:$\frac{6.6g}{44g/mol}$=1.5mol,
碱石灰增重的质量为二氧化碳和水的质量,由于CO2和H2O的物质的量相等,设其物质的量为x,则18x+44x=18.6g,解得:x=0.3mol,
根据质量守恒,该有机物分子中含有的C、H原子数分别为:N(C)=$\frac{0.3mol}{0.15mol}$=2、N(H)=$\frac{0.3mol×2}{0.15mol}$=4,
该有机物分子中含有O原子数为:N(O)=$\frac{44-12×2-1×4}{16}$=1,
所以该有机物的分子式为:C2H4O,
答:该有机物的分子式为C2H4O.
点评 本题考查了有机物分子式确定的计算,题目难度中等,明确相对密度与相对分子质量的关系为解答关键,注意掌握质量守恒定律在确定有机物分子式中的应用.

练习册系列答案
相关题目
3.如图为铜-锌-稀硫酸原电池示意图,下列表述正确的是( )
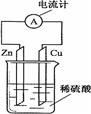

| A. | 电子由铜片通过导线流向锌片 | B. | 正极上的反应为Zn-2e-═Zn2+ | ||
| C. | 反应一段时间后,溶液的pH变小 | D. | 原电池的反应本质是氧化还原反应 |
4. 用如图所示装置进行下列实验,实验结果与预测现象不一致的是( )
用如图所示装置进行下列实验,实验结果与预测现象不一致的是( )
 用如图所示装置进行下列实验,实验结果与预测现象不一致的是( )
用如图所示装置进行下列实验,实验结果与预测现象不一致的是( )| 选项 | ①中物质 | ②中物质 | 预测①中现象 |
| A | 酚酞溶液 | 浓氨水 | 无色变红色 |
| B | 湿润红布条 | 饱和氯水 | 红布条褪色 |
| C | 淀粉KI溶液 | 浓硝酸 | 无明显变化 |
| D | 硝酸银溶液 | 浓盐酸 | 有白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
8.由两种饱和一元醇(分子中没有不饱和键,只有一个羟基)组成的混合物,经测定质量为0.78g,该混合物与足量钠反应生成224mL H2(标准状况),则两种醇的分子式是( )
| A. | CH3OH,C3H7OH | B. | C2H5OH,C3H7OH | C. | C3H7OH,C4H9OH | D. | C2H5OH,C4H9OH |
2.下列物质中,属于酸的是( )
| A. | H3PO4 | B. | NaOH | C. | MgO | D. | KNO3 |

 “阿穆尔”级潜艇采用低温氢氧燃料电池作动力装置,具有优良的续航能力.当氢氧燃料电池中有1.8L水产生时,电池内转移的电子数为200NA.
“阿穆尔”级潜艇采用低温氢氧燃料电池作动力装置,具有优良的续航能力.当氢氧燃料电池中有1.8L水产生时,电池内转移的电子数为200NA.