题目内容
2.有关甲苯的实验事实中,能说明苯环对侧链性质的影响的是( )| A. | 甲苯和硝酸反应生成三硝基甲苯 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色 | |
| C. | 1mol甲苯能与3mol氢气发生加成反应 | |
| D. | 甲苯可以燃烧并产生浓烈的黑烟 |
分析 A.甲苯和苯都能发生取代反应;
B.苯、甲烷不能被酸性KMnO4溶液氧化,甲苯能被酸性KMnO4溶液氧化为苯甲酸;
C.苯也能与氢气发生加成反应;
D.燃烧产生带浓烟的火焰说明含碳量高,不完全燃烧.
解答 解:A.甲苯和苯都能与浓硝酸、浓硫酸发生取代反应,所以不能说明苯环对侧链有影响,故A错误;
B.甲苯可看作是CH4中的1个H原子被-C6H5取代,苯、甲烷不能被酸性KMnO4溶液氧化使其褪色,甲苯能被酸性KMnO4溶液氧化为苯甲酸,苯环未变化,侧链甲基被氧化为羧基,说明苯环影响甲基的性质,故B正确;
C.苯、甲苯都能能与H2发生加成反应,是苯环体现的性质,不能说明苯环对侧链性质产生影响,故C错误;
D.燃烧产生带浓烟的火焰说明含碳量高,不能说明苯环对侧链性质产生影响,故D错误,
故选B.
点评 本题以苯及其同系物的性质考查为载体,旨在考查苯的同系物中苯环与侧链的相互影响,通过实验性质判断,考查学生的分析归纳能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.相等物质的量的H2O和H2O2相比较,下列有关叙述中正确的是( )
①它们所含的分子数目之比为1:1 ②它们所含的原子总数目之比为3:4 ③它们所含的O原子数目之比为1:2 ④它们所含的H原子数目之比为1:1 ⑤它们所含的质子数目之比为5:9.
①它们所含的分子数目之比为1:1 ②它们所含的原子总数目之比为3:4 ③它们所含的O原子数目之比为1:2 ④它们所含的H原子数目之比为1:1 ⑤它们所含的质子数目之比为5:9.
| A. | ①②③ | B. | ③④⑤ | C. | ①②④ | D. | ①②③④⑤ |
10.锌与稀硝酸反应生成Zn(NO3)2、NH4NO3和水.当生成1mol Zn(NO3)2时,消耗的硝酸的物质的量为( )
| A. | 2mol | B. | 1mol | C. | 2.25 mol | D. | 2.5 mol |
17.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中发生的反应有Zn+Cu2+=Zn2++Cu、Zn+2H+=Zn2++H2↑.(离子方程式)
(2)硫酸铜溶液可以加快氢气生成速率的原因是通过一系列反应构成了原电池,写出该原电池的电极反应式,负极:Zn-2e-=Zn2+;正极:2H++2e-=H2↑.
(3)要加快上述实验中气体产生的速率,还可采取的措施有BC.
A.将稀硫酸换成浓硫酸 B.适当升高温度
C.用锌粉代替锌粒 D.增加上述稀硫酸的用量
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V6=10,V9=17.5;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
(1)上述实验中发生的反应有Zn+Cu2+=Zn2++Cu、Zn+2H+=Zn2++H2↑.(离子方程式)
(2)硫酸铜溶液可以加快氢气生成速率的原因是通过一系列反应构成了原电池,写出该原电池的电极反应式,负极:Zn-2e-=Zn2+;正极:2H++2e-=H2↑.
(3)要加快上述实验中气体产生的速率,还可采取的措施有BC.
A.将稀硫酸换成浓硫酸 B.适当升高温度
C.用锌粉代替锌粒 D.增加上述稀硫酸的用量
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
7.在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质,下列实验现象和结论一致且正确的是( )
| A. | 加入有色布条,有色布条褪色,说明溶液中有氯气分子存在 | |
| B. | 溶液呈现黄绿色,且有刺激性气味,说明有氯气分子存在 | |
| C. | 先加入盐酸酸化,再加入硝酸银溶液产生白色沉淀,说明有Cl-存在 | |
| D. | 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在 |
11.电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是( )
| A. | 阳极反应为Fe-2e-═Fe2+ | |
| B. | 过程中有Fe(OH)3沉淀生成 | |
| C. | 电路中每转移12mol电子,最多有1molCr2O72-被还原 | |
| D. | 如果石墨做阴阳极,电解过程不变 |
 ,F元素离子基态时的电子排布式1s22s22p63s23p6,E元素的原子结构示意图是
,F元素离子基态时的电子排布式1s22s22p63s23p6,E元素的原子结构示意图是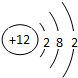 .
.