题目内容
7.在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质,下列实验现象和结论一致且正确的是( )| A. | 加入有色布条,有色布条褪色,说明溶液中有氯气分子存在 | |
| B. | 溶液呈现黄绿色,且有刺激性气味,说明有氯气分子存在 | |
| C. | 先加入盐酸酸化,再加入硝酸银溶液产生白色沉淀,说明有Cl-存在 | |
| D. | 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在 |
分析 氯气溶于水,部分与水发生反应:Cl2+H2O?HCl+HClO,该反应是可逆反应,所以氯水中含有的微粒是:分子:Cl2、HClO、H2O;离子:H+、Cl-、ClO-、OH-,依据存在微粒的性质解答.
解答 解:A.色布条褪色是因为溶液中含有次氯酸,次氯酸具有漂白性,故A错误;
B.氯气具有黄绿色,溶液呈现黄绿色,且有刺激性气味,说明有氯气分子存在,故B正确;
C.盐酸中含有氯离子,向氯水中加入盐酸后再加入硝酸银溶液生成氯化银白色沉淀,不能说明氯水中含有氯离子,故C错误;
D.Cl2+H2O?HCl+HClO,该反应是可逆反应,向氯水中加入氢氧化钠溶液,氯水黄绿色消失,说明氯水溶液呈酸性,不能证明含有次氯酸,故D错误;
故选:B.
点评 本题考查了氯水的性质,明确氯水中存在的微粒及微粒的性质是解题关键,注意氯气不具有漂白性,题目难度不大.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
18.FeCl3溶液、Fe(OH)3胶体、Fe(OH)3浊液是三种重要的分散系,下列叙述中不正确的是( )
| A. | Fe(OH)3胶体区别于其他分散系的本质特征是分散质粒子的直径在10-9~10-7米之间 | |
| B. | 分别用一束光透过三种分散系,只有Fe(OH)3胶体具有丁达尔效应 | |
| C. | 三种分散系的颜色都相同,且均能与盐酸反应,具有吸附性 | |
| D. | 三种分散系中分散质均属于电解质 |
15.用惰性电极电解饱和Na2SO4溶液,若保持温度不变,电解一段时间后,下列有关说法正确的是( )
| A. | 溶液的pH变大 | |
| B. | c(Na+)与c(SO42-)的比值不变 | |
| C. | 电解过程中,向阳极附近溶液滴入酚酞,溶液变为红色 | |
| D. | 阴、阳极产生气体在相同条件下体积之比为1:2 |
2.有关甲苯的实验事实中,能说明苯环对侧链性质的影响的是( )
| A. | 甲苯和硝酸反应生成三硝基甲苯 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色 | |
| C. | 1mol甲苯能与3mol氢气发生加成反应 | |
| D. | 甲苯可以燃烧并产生浓烈的黑烟 |
 将可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O设计成如图所示的电化学装置,其中C1、C2均为碳棒.回答下列问题:
将可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O设计成如图所示的电化学装置,其中C1、C2均为碳棒.回答下列问题:
 .
. +C2H5OH$?_{△}^{浓硫酸}$
+C2H5OH$?_{△}^{浓硫酸}$ +H2O.
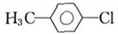
+H2O.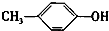 +CH2I→
+CH2I→ +HI.
+HI. 的同分异构体有多种,其中既含有酚羟基又含有酯基的同分异构体共有19种.
的同分异构体有多种,其中既含有酚羟基又含有酯基的同分异构体共有19种.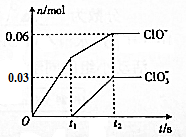 将-定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),ClO-和ClO${\;}_{3}^{-}$的物质的量(n)与反应时间(t)的变化关系如图所示,则t2时刻,n(还原产物):n(氧化产物)为( )
将-定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),ClO-和ClO${\;}_{3}^{-}$的物质的量(n)与反应时间(t)的变化关系如图所示,则t2时刻,n(还原产物):n(氧化产物)为( )