题目内容
12.A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增.已知:B原子核外最外层电子数是次外层电子数的两倍,电子总数是E原子总数的$\frac{1}{2}$,F是同周期元素中原子半径最小的元素;D2-与E2+的电子层结构相同.B与D可以形成三原子化合物甲.A是非金属元素,且A、C、F可形成离子化合物乙.请回答:(1)C单质的电子式
 ,F元素离子基态时的电子排布式1s22s22p63s23p6,E元素的原子结构示意图是
,F元素离子基态时的电子排布式1s22s22p63s23p6,E元素的原子结构示意图是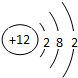 .
.(2)化合物乙中含有的化学键是离子键、共价键、配位键
(3)化合物甲为固体时属于分子晶体,E单质在一定条件下与甲反应的化学方程式为2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(4)ABC分子中的三个原子除A原子外均为8电子构型,写出该分子的结构式H-C≡N,根据电子云重叠方式的不同,分子里共价键的类型有σ键、π键;
(5)常温下,CA3呈气态,但易被液化,且极易溶于水,其原因是NH3分子之间存在氢键,沸点高,易液化.NH3与H2O之间易形成氢键,NH3与H2O都是极性分子,相似相溶,NH3与H2O能反应,极易溶于水;
(6)液态的CA3是一种重要的溶剂,其性质与H2O相似,可以与活泼金属反应,写出Na与液态CA3反应的化学方程式2Na+2NH3=2NaNH2+H2↑.
分析 A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增.B原子核外最外层电子数是次外层电子数的两倍,原子只能有2个电子层,最外层电子数为4,故B为碳元素;B原子电子总数是E原子总数的$\frac{1}{2}$,则E原子核外电子数为12,故E为Mg;由原子序数可知,F处于第三周期,F是同周期元素中原子半径最小的元素,故F为Cl;D2-与E2+的电子层结构相同,离子核外电子数为10,故D为O元素;C的原子序数介于碳、氧之间,故C为N元素;B与D可以形成三原子化合物甲为CO2;A是非金属元素,且A、C、F可形成离子化合物乙,则A为H元素,乙为NH4NO3,据此解答.
解答 解:A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增.B原子核外最外层电子数是次外层电子数的两倍,原子只能有2个电子层,最外层电子数为4,故B为碳元素;B原子电子总数是E原子总数的$\frac{1}{2}$,则E原子核外电子数为12,故E为Mg;由原子序数可知,F处于第三周期,F是同周期元素中原子半径最小的元素,故F为Cl;D2-与E2+的电子层结构相同,离子核外电子数为10,故D为O元素;C的原子序数介于碳、氧之间,故C为N元素;B与D可以形成三原子化合物甲为CO2;A是非金属元素,且A、C、F可形成离子化合物乙,则A为H元素,乙为NH4NO3.
(1)C单质为N2,分子中N原子之间形成3对共用电子对,电子式为 ,F为Cl元素,Cl-的电子排布式为1s22s22p63s23p6,E为Mg元素,原子结构示意图是
,F为Cl元素,Cl-的电子排布式为1s22s22p63s23p6,E为Mg元素,原子结构示意图是 ,
,
故答案为: ;1s22s22p63s23p6;
;1s22s22p63s23p6; ;
;
(2)化合物乙为NH4NO3,含有的化学键有:离子键、共价键、配位键,故答案为:离子键、共价键、配位键;
(3)化合物甲为CO2,固体时属于分子晶体,Mg在二氧化碳燃烧生成MgO与碳,反应方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,
故答案为:分子;2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(4)ABC分子为HCN,分子中的三个原子除H原子外均为8电子构型,该分子的结构式为:H-C≡N,根据电子云重叠方式的不同,分子里共价键的类型有:σ键、π键,
故答案为:H-C≡N;σ键、π键;
(5)常温下,NH3呈气态,但易被液化,且极易溶于水,其原因是:NH3分子之间存在氢键,沸点高,易液化.NH3与H2O之间易形成氢键,NH3与H2O都是极性分子,相似相溶,NH3与H2O能反应,极易溶于水,
故答案为:NH3分子之间存在氢键,沸点高,易液化.NH3与H2O之间易形成氢键,NH3与H2O都是极性分子,相似相溶,NH3与H2O能反应,极易溶于水;
(6)液态的NH3是一种重要的溶剂,其性质与H2O相似,可以与活泼金属反应,Na与液态NH3反应的化学方程式为:2Na+2NH3=2NaNH2+H2↑,
故答案为:2Na+2NH3=2NaNH2+H2↑.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对化学用语的考查,有利于基础知识的巩固,注意氢键对物质性质的影响.

| A. | 常温下锌与浓硫酸不反应,与稀硫酸反应生成氢气 | |
| B. | 加入过量氨水,有白色沉淀生成,则原溶液一定有Al3+ | |
| C. | 向FeI2溶液中通入少量Cl2,再滴加少量CCl4,振荡、静置,下层液体为紫色 | |
| D. | FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体剩余,加入KCSN溶液变成血红色 |
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )| A. | 反应开始到10 s时,用Z表示的反应速率为0.158 mol•(L•s)-1 | |
| B. | 反应开始到10 s时,X的物质的量浓度减少了0.79 mol•L-1 | |
| C. | 反应开始到10 s时,Y的转化率为39.5% | |
| D. | 反应的化学方程式为X(g)+Y(g)?2Z(g) |
| A. | CH3COCH3 | B. | CH3CH2CHO | C. | CH3CHOHCH3 | D. | CH3CH2COOH |
| A. | 标准状况下,22.4L CH3OH所含中子数为14NA | |
| B. | 常温常压下,1mol Na2CO3所含CO32-的数目等于NA | |
| C. | 56g Fe与足量水蒸气反应,转移的电子数目为$\frac{8}{3}$NA | |
| D. | 1L pH=0的H2SO4所含H+数目为NA |
| A. | 甲苯和硝酸反应生成三硝基甲苯 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色 | |
| C. | 1mol甲苯能与3mol氢气发生加成反应 | |
| D. | 甲苯可以燃烧并产生浓烈的黑烟 |
 氨气是一种重要工业原料,在工农业生产中具有重要的应用.
氨气是一种重要工业原料,在工农业生产中具有重要的应用.