题目内容
11.电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是( )| A. | 阳极反应为Fe-2e-═Fe2+ | |
| B. | 过程中有Fe(OH)3沉淀生成 | |
| C. | 电路中每转移12mol电子,最多有1molCr2O72-被还原 | |
| D. | 如果石墨做阴阳极,电解过程不变 |
分析 A.Fe板作阳极,为活性电极,Fe失电子,发生氧化反应生成亚铁离子;
B.阴极发生还原反应,溶液中的氢离子得到电子减少,同时生成氢氧根;
C.Fe-2e-=Fe2+,则转移电子数12mol需要6molFe,再根据能够处理的关系式,得6Fe~12e-~6Fe2+~Cr2O72-,据此计算;
D、电解池的阳极不是活泼金属电极,该电极上是电解质里的阴离子发生失电子的还原反应.
解答 解:A.Fe板作阳极,为活性电极,Fe失电子,发生氧化反应生成亚铁离子,阳极反应为Fe-2e-═Fe2+,故A正确;
B.阴极发生还原反应,溶液中的氢离子得到电子减少,同时生成氢氧根,有Fe(OH)3沉淀生成,故B正确;
C.Fe-2e-=Fe2+,则转移电子数12mol需要6molFe,再根据能够处理的关系式,得6Fe~12e-~6Fe2+~Cr2O72-,故被还原的Cr2O72-的物质的量为1mol,故C正确;
D.如果石墨做阴阳极,则不会出现还原性的亚铁离子,则不会发生重铬酸根离子被还原的反应,电解过程发生变化,故D错误;
故选D
点评 本题考查电解原理、氧化还原反应等,清楚发生的电极反应是解题的关键,是对学生综合能力的考查,难度中等.

练习册系列答案
相关题目
1.NA为阿伏伽德罗常数的值.下列叙述错误的是( )
| A. | 标准状况下,22.4L CH3OH所含中子数为14NA | |
| B. | 常温常压下,1mol Na2CO3所含CO32-的数目等于NA | |
| C. | 56g Fe与足量水蒸气反应,转移的电子数目为$\frac{8}{3}$NA | |
| D. | 1L pH=0的H2SO4所含H+数目为NA |
2.有关甲苯的实验事实中,能说明苯环对侧链性质的影响的是( )
| A. | 甲苯和硝酸反应生成三硝基甲苯 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色 | |
| C. | 1mol甲苯能与3mol氢气发生加成反应 | |
| D. | 甲苯可以燃烧并产生浓烈的黑烟 |
 将可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O设计成如图所示的电化学装置,其中C1、C2均为碳棒.回答下列问题:
将可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O设计成如图所示的电化学装置,其中C1、C2均为碳棒.回答下列问题:
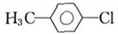 .
. +C2H5OH$?_{△}^{浓硫酸}$
+C2H5OH$?_{△}^{浓硫酸}$ +H2O.
+H2O.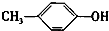 +CH2I→
+CH2I→ +HI.
+HI. 的同分异构体有多种,其中既含有酚羟基又含有酯基的同分异构体共有19种.
的同分异构体有多种,其中既含有酚羟基又含有酯基的同分异构体共有19种.