题目内容
14.用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池.以下有关该原电池的叙述正确的是( )①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
⑤盐桥中的K+移向Cu(NO3)2溶液
⑥铜片质量增加
⑦Cu(NO3)2溶液中的Cu2+浓度逐渐减小.
| A. | ①②⑤⑦ | B. | ②③⑥ | C. | ②④ | D. | ②④⑤⑥ |
分析 原电池中,较活泼的金属作负极,负极上金属失去电子发生氧化反应,较不活泼的金属作正极,正极上得电子发生还原反应,外电路上,电子从负极沿导线流向正极,以此解答该题.
解答 解:原电池中,较活泼的金属铜作负极,负极上金属铜失去电子发生氧化反应,较不活泼的金属银作正极,正极上银离子得电子发生还原反应,外电路上,电子从负极沿导线流向正极,
①在外电路中,电流由银电极流向铜电极,故错误;
②正极上得电子发生还原反应,所以反应为:Ag++e-=Ag,故正确;
③实验过程中取出盐桥,不能构成闭合回路,所以原电池不能继续工作,故错误;
④该原电池的电极反应式为:负极:Cu-2e-=Cu2+正极:Ag++e-=Ag,故总反应为Cu+2Ag+=Cu2++2Ag.铜片与硝酸银反应的离子方程式为Cu+2Ag+=Cu2++2Ag,与原电池的总反应相同,故正确.
⑥铜为负极,被氧化,铜片质量减小,故错误;
⑦铜为负极,被氧化,Cu(NO3)2溶液中的Cu2+浓度逐渐增大,故错误.
故选C.
点评 本题考查了原电池原理,难度不大,明确原电池放电时外电路上电流的流向、电极上发生的反应、原电池的构成条件即可分析解答本题.

练习册系列答案
相关题目
5.mg某双原子分子的气体在标准状况下的体积为V1L,其摩尔质量为Mg/mol,将其溶于水(该气体与水不反应)得到体积为V2L的溶液,NA表示阿伏加德罗常数的值,则下列错误的是( )
| A. | 该气体分子的摩尔质量为22.4mV1g/mol | |
| B. | 该气体分子中含有的原子数目为NAV122.4g/mol | |
| C. | 该气体溶于水后得到溶液的物质的量浓度为mMV2mol/L | |
| D. | 该气体溶于水后得到溶液的物质的量浓度V122.4V2mol/L |
2.有关甲苯的实验事实中,能说明苯环对侧链性质的影响的是( )
| A. | 甲苯和硝酸反应生成三硝基甲苯 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色 | |
| C. | 1mol甲苯能与3mol氢气发生加成反应 | |
| D. | 甲苯可以燃烧并产生浓烈的黑烟 |
4.已知①Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓②Na2CO3+SiO2高温_NaSiO3+CO2↑ 下列有关说法不正确是( )
| A. | 反应①是熵减小的反应,而反应②是熵增大的反应 | |
| B. | 反应②高温时能自发迸行.是由于生成CO2使熵值增大 | |
| C. | 上述事实说明的H2SiO3酸性有时比H2CO3强,有时比H2CO3弱 | |
| D. | H2CO3酸性强于H2SiO3,不能用反应②进行解释 |
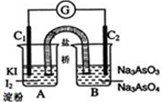 将可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O设计成如图所示的电化学装置,其中C1、C2均为碳棒.回答下列问题:
将可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O设计成如图所示的电化学装置,其中C1、C2均为碳棒.回答下列问题: