题目内容
【题目】用石墨电极电解饱和食盐水,下列分析错误的是
A.得电子能力H+>Na+,故阴极得到H2
B.水电离平衡右移,故阴极区得到OH-
C.失电子能力Cl->OH-,故阳极得到Cl2
D.OH-向阴极移动,故阳极区滴酚酞不变红
【答案】D
【解析】
A. 得电子能力H+>Na+,电解饱和食盐水阴极:2H++2e-═H2↑,故A正确;
B. 电解饱和食盐水过程中,H+被消耗,促进水的电离,阴极消耗H+同时得到OH-,故B正确;
C. 失电子能力Cl->OH-,电解饱和食盐水阳极:2Cl--2e- = Cl2 ![]() ,故阳极得到Cl2,故C正确;
,故阳极得到Cl2,故C正确;
D. D. 电解池中,阴离子会向阳极移动,而阴极氢离子放电,使整个溶液显碱性,因此阳极区滴酚酞也会变红,故D错误;
故选D。

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
【题目】某无色稀溶液X中,可能含有下表所列离子中的某几种。
阴离子 | CO |
阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y体积(V)的关系如图所示,下列说法正确的是( )
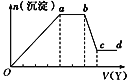
A.若Y是盐酸,则Oa段转化为沉淀的离子(上表中,下同)只有[Al(OH)4]-
B.若Y是盐酸,则溶液中可能含有的阳离子是Al3+
C.若Y是NaOH溶液,则bc段反应的离子方程式为Al(OH)3+OH-=[Al(OH)4]-
D.若Y是NaOH溶液,则X溶液中只存在四种离子,是Al3+、Fe3+、NH4+、Cl-