题目内容
13.假设体积可以相加,下列叙述中正确的是( )| A. | pH=12的氨水,加水稀释100倍后溶液pH=10 | |
| B. | 90℃纯水的pH=6.2,则说明加热可导致水呈酸性 | |
| C. | 0.1mol•L-1的硫酸,与等体积水混合后溶液pH=1(假设混合后溶液的体积不变) | |
| D. | pH=3的盐酸与pH=11的氨水等体积混合后pH=7 |
分析 A、弱碱的稀释规律:将pH=a的弱碱加水稀释10b倍后,溶液的pH>a-b;
B、纯水永远显中性;
C、溶液体积扩大一倍,浓度减为原来二分之一;
D、考虑一水合氨是弱碱,不完全电离,故与盐酸混合后会过量.
解答 解:A、根据弱碱的稀释规律:将pH=a的弱碱加水稀释10b倍后,溶液的pH>a-b,可知,pH=12的氨水,稀释至100倍后pH>10,故A错误;
B、温度升高,水的电离程度增大,溶液中氢离子浓度升高,但一直有C(H+)=C(OH-),故无论温度有多高,pH有多小,纯水永远呈中性,故B错误;
C、0.1mol•L-1的硫酸,氢离子浓度为0.2mol/L,与等体积水混合后氢离子浓度变为0.1mol/L,故pH=1,故C正确;
D、pH=3的盐酸与pH=11的氨水等体积混合,一水合氨是弱碱,不完全电离,故与盐酸混合后会有大量一水合氨过量,即得到氯化铵和大量一水合氨的混合物,由于一水合氨的电离大于铵根离子的水解,故溶液呈碱性,pH>7,故D错误.
故选C.
点评 本题考查了有关pH的简单计算,注意纯水永远呈中性、弱酸存在电离平衡对计算的影响.题目难度不大.

练习册系列答案
相关题目
1.下列有关能量变化和原因的相关叙述正确的是( )
| A. | 反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小 | |
| B. | 铝热剂焊接钢轨主要利用的是光能 | |
| C. | 动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应是放热反应 |
8.某烃的组成中含碳、氢元素的质量比为6:1,该烃对氮气的相对密度为2,该烃能与H2发生加成反应,所得加氢产物的二氯代物有三种同分异构体,则该烃为( )
| A. | CH2=CH-CH2-CH3 | B. | CH2=CH2 | C. | CH3-CH=CH-CH3 | D. | 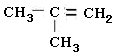 |
18.已知H2(g)+Br2(g)=2HBr(g)△H=-72kJ/mol,其他相关数据如下表:
则表中a为( )
| H2(g) | Br2(g) | HBr(g) | |
| 1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | a | 366 |
| A. | 404 | B. | 368 | C. | 224 | D. | 200 |
5.相同物质的量的Na2O2和Na2O的比较中,不正确的是( )
| A. | 所含原子个数之比为4:3 | B. | 所含离子个数之比为4:3 | ||
| C. | 所含氧原子个数之比为2:1 | D. | 所含钠的质量之比为1:1 |
2. 如图是一种化肥包装袋上的部分说明,该化肥属于( )
如图是一种化肥包装袋上的部分说明,该化肥属于( )
 如图是一种化肥包装袋上的部分说明,该化肥属于( )
如图是一种化肥包装袋上的部分说明,该化肥属于( )| A. | 氮肥 | B. | 磷肥 | C. | 钾肥 | D. | 复合肥料 |