题目内容
5.相同物质的量的Na2O2和Na2O的比较中,不正确的是( )| A. | 所含原子个数之比为4:3 | B. | 所含离子个数之比为4:3 | ||
| C. | 所含氧原子个数之比为2:1 | D. | 所含钠的质量之比为1:1 |
分析 A.1molNa2O2含有4mol原子,1molNa2O含有3mol原子;
B.Na2O2由钠离子与过氧根离子构成,Na2O由钠离子与阳离子构成;
C.1molNa2O2含有2molO原子,1molNa2O含有1molO原子;
D.1molNa2O2含有2molNa原子,1molNa2O含有2molNa原子.
解答 解:A.1molNa2O2含有4mol原子,1molNa2O含有3mol原子,故相同物质的量的Na2O2和Na2O的含有原子数目之比是4:3,故A正确;
B.Na2O2由钠离子与过氧根离子构成,1molNa2O2含有3mol离子,Na2O由钠离子与阳离子构成,1molNa2O含有3mol离子,相同物质的量的Na2O2和Na2O含有离子个数之比是1:1,故B错误;
C.1molNa2O2含有2molO原子,1molNa2O含有1molO原子,相同物质的量的Na2O2和Na2O所含氧原子个数之比为2:1,故C正确;
D.1molNa2O2含有2molNa原子,1molNa2O含有2molNa原子,相同物质的量的Na2O2和Na2O所含钠的质量之比为1:1,故D正确,
故选:B.
点评 本题考查物质的量计算,涉及微粒数目计算,比较基础,注意对化学式意义的理解.

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案
相关题目
16.某烃的结构简式为: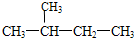 ,它的名称是( )
,它的名称是( )
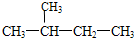 ,它的名称是( )
,它的名称是( )| A. | 3-甲基戊烷 | B. | 2,3-二甲基丙烷 | C. | 2-甲基丁烷 | D. | 3-甲基丁烷 |
13.假设体积可以相加,下列叙述中正确的是( )
| A. | pH=12的氨水,加水稀释100倍后溶液pH=10 | |
| B. | 90℃纯水的pH=6.2,则说明加热可导致水呈酸性 | |
| C. | 0.1mol•L-1的硫酸,与等体积水混合后溶液pH=1(假设混合后溶液的体积不变) | |
| D. | pH=3的盐酸与pH=11的氨水等体积混合后pH=7 |
20.下列事实不能用勒夏特列原理解释的是( )
| A. | 溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 | |
| B. | 反应H2(g)+I2(g)?2HI(g) 达到平衡后,压缩容器的体积,体系颜色加深 | |
| C. | 反应CO(g)+NO2(g)═CO2(g)+NO(g)△H<0,达平衡后,升高温度体系颜色变深 | |
| D. | 增大压强,有利于SO2与O2反应生成SO3 |
10.在下列反应中,HCl作还原剂的是( )
| A. | Al2O3+6HCl=2AlCl3+3H2O | |
| B. | 2Al+6HCl=2AlCl3+3H2↑ | |
| C. | Al(OH)3+3HCl=AlCl3+3H2O | |
| D. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O |
17.下列物质中,属于盐类的是( )
| A. | MgO | B. | NaOH | C. | H2SO4 | D. | BaCO3 |
15.下列有关物质检验的实验结论正确的是( )
| 选项 | 实 验 操 作 及 现 象 | 实 验 结 论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 向某溶液中加入2滴KSCN溶液,溶液不显红色.再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| C | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
| D | 取1mL20%的蔗糖溶液,加入3~5滴稀硫酸,水浴加热5min后,直接加入少量新制备的Cu(OH)2,加热3~5min,没有产生砖红色沉淀 | 说明蔗糖没有水解. |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |