题目内容
19.已知标准状况下11.2LA气体分子的质量为16g,则A气体的摩尔质量是( )| A. | 16g | B. | 32g | C. | 64g/mol | D. | 32g/mol |
分析 根据n=$\frac{V}{{V}_{m}}$计算气体的物质的量,再根据M=$\frac{m}{n}$计算该气体的摩尔质量.
解答 解:标准状况下,11.2L A气体的质量为16g,该气体的物质的量=$\frac{11.2L}{22.4L/mol}$=0.5mol,
则该气体的摩尔质量=$\frac{16g}{0.5mol}$=32g/mol,
故选D.
点评 本题考查物质的量有关计算,比较基础,注意对公式的理解与灵活应用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.下列有关化学用语错误的是( )
| A. | N原子价层轨道表示式: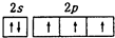 | |
| B. | H2O电子式为 | |
| C. | Ca2+离子基态电子排布式为1s22s22p63s23p6 | |
| D. | 钾(K)原子的原子结构示意图为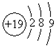 |
7.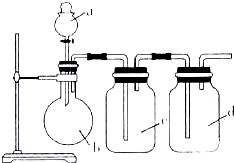 拟用如图所示装置制取四种干燥、纯净的气体(图中加热装置和气体的收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂).其中不能达到目的是( )
拟用如图所示装置制取四种干燥、纯净的气体(图中加热装置和气体的收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂).其中不能达到目的是( )
 拟用如图所示装置制取四种干燥、纯净的气体(图中加热装置和气体的收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂).其中不能达到目的是( )
拟用如图所示装置制取四种干燥、纯净的气体(图中加热装置和气体的收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂).其中不能达到目的是( )| 选项 | 制取气体 | a | b | c | d |
| A | NO | 稀硝酸 | 铜片 | H2O | 浓硫酸 |
| B | O2 | 双氧水 | MnO2 | H2O | 浓硫酸 |
| C | NH3 | 浓氨水 | 碱石灰 | 浓硫酸 | H2O |
| D | SO2 | 浓盐酸 | Na2SO3粉末 | NaHSO3溶液 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
14.某链状有机物分子中含有m个-CH3,n个-CH2-,a个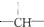 ,其余为-Cl,则-Cl的数目可能是( )
,其余为-Cl,则-Cl的数目可能是( )
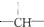 ,其余为-Cl,则-Cl的数目可能是( )
,其余为-Cl,则-Cl的数目可能是( )| A. | 2n+3a-m | B. | a+2-m | C. | n+m+a | D. | a+2n+2-m |
4.有X、Y两种元素,相对原子质量分别为56、16,化合价分别为+3和-2,则X和Y组成的化合物的相对分子质量为?( )
| A. | 72 | B. | 88 | C. | 160 | D. | 200 |
11.下列化学用语表达错误的是( )
| A. | 甲烷的结构式: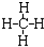 | B. | 丙烯的结构简式CH3CHCH2 | ||
| C. | 葡萄糖分子式:C6H12O6 | D. | 甲烷分子球棍模型: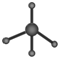 |
8.下列实验方案合理的是( )
| A. | 制备乙炔:实验室不能用启普发生器来制取乙炔 | |
| B. | 制备乙酸乙酯:将乙醇和乙酸混合,再加入稀硫酸共热 | |
| C. | 制备一氯乙烷:将乙烷和氯气的混合气放在光照条件下反应 | |
| D. | 制备乙烯:实验室用无水乙醇和浓硫酸共热到170℃制取乙烯 |
9.设NA表示阿佛加德罗常数,下列说法正确的是( )
| A. | 0.1mol冰醋酸、0.1mol无水乙醇和浓硫酸混合加热后可得0.1NA个乙酸乙酯分子 | |
| B. | 0.1molL-1Na2SO4溶液中含2NA个Na+ | |
| C. | 2.7g的铝是足量的NaOH溶液充分反应,转移的电子数为0.3NA | |
| D. | 标准状况下,11.2升CCl4中所含的氯原子数目为2NA |
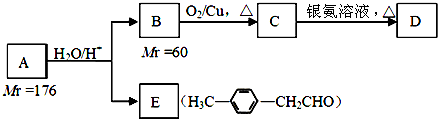
 .
.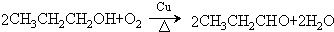 .
. 、
、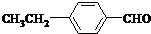 .
.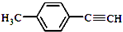 )的合成路线流程图如下:
)的合成路线流程图如下: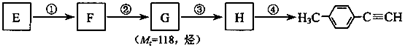
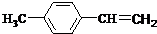 ,③的反应类型为加成反应.
,③的反应类型为加成反应.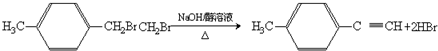 .
.