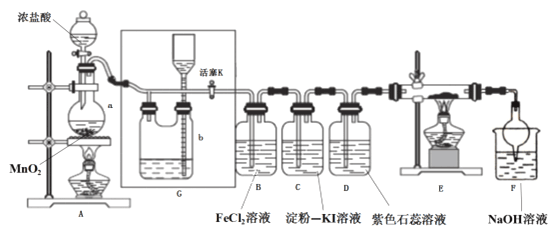
题目内容
【题目】把500 mL NH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入足量NaOH溶液,充分反应后消耗 a mol NaOH ,另取一份加入足量盐酸,充分反应后消耗b mol HCl,则该混合溶液中c(Na+)为 ( ) (已知:NaHCO3 + NaOH = Na2CO3 + H2O)
A.(![]() )mol/LB.(
)mol/LB.(![]() )mol/L
)mol/L
C.(10b-5a) mol/LD.(2b-a) mol/L
【答案】C
【解析】
设100mL溶液中含有NH4HCO3xmol,Na2CO3ymol,NH4HCO3和Na2CO3的混合溶液加入NaOH,反应为:
NH4HCO3+2NaOH═NH3·H2O+Na2CO3+H2O,
1 2
x amol
解得:x=0.5amol;故:NH4HCO3为0.5amol;
加入含b mol HCl的盐酸的反应为:
NH4HCO3+HCl═NH4Cl+CO2↑+H2O,Na2CO3+2HCl═2NaCl+H2O+CO2↑,
1 1 1 2
0.5amol n(HCl) y b-n(HCl)
解得:n(HCl)=0.5amol,y=![]() (b-0.5amol);
(b-0.5amol);
n(Na+)=2n(Na2CO3)=(b-0.5a)mol,
c(Na+)=![]() =(10b-5a)mol/L。
=(10b-5a)mol/L。
答案选C。

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目