题目内容
9.有一种矿石,经测定知镁、硅、氧元素的质量比是12:7:16①用盐的形式表示其组成:Mg2SiO4(写化学式)
②用氧化物的形式表示其组成:2MgO•SiO2(写化学式)
③该矿石的成分属于盐类(填物质的类别)
④该盐中的阴离子SiO44-(写化学式)
分析 根据n=$\frac{m}{M}$及原子个数比=原子的物质的量之比进行计算,得出正确结论;由金属离子和酸根离子组成的化合物属于盐.
解答 解:镁、硅、氧的质量比为12:7:16,则镁、硅、氧的原子个数比为$\frac{12}{24}$:$\frac{7}{28}$:$\frac{16}{16}$=2:1:4,
(1)该矿石用盐的组成可表示为:Mg2SiO4,故答案为:Mg2SiO4;
(2)该矿石用氧化物的组成可表示为:2MgO•SiO2,故答案为:2MgO•SiO2;(3)Mg2SiO4属于盐类,故答案为:盐类;
(4)Mg2SiO4阴离子为SiO44-,故答案为:SiO44-.
点评 本题考查矿石的两种表示方法及相关计算,难度不大.要注意矿石用氧化物的组成表示的方法.

练习册系列答案
相关题目
19.已知溶质质量分数为98%的浓硫酸,其物质的量浓度为18.4mol/L,取10mL该硫酸与a mL水混合,配制成溶质质量分数为49%的硫酸,其物质的量浓度为bmol/L,则a,b分别为( )
| A. | a=10、b=9.2 | B. | a<10、b>9.2 | C. | a>10、b=9.2 | D. | a>10、b<9.2 |
20.在一恒定容积的容器中充入4mol A和2mol B发生如下反应:2A(g)+B(g)?ξΧ(γ),达到平衡后,Χ的体积分数为Ω%,若维持容积和温度不变,按1.2μολΑ、0.6μολΒ和2.8μολΧ为起始物质,达到平衡后,Χ的体积分数仍为Ω%,则ξ的<为( )
| A. | 只能为2 | B. | 只能为3 | ||
| C. | 可能为2,也可能为3 | D. | 无法确定 |
17.下列实验不能达到目的是( )
| A. | 向Na2SiO3溶液中滴加酚酞,溶液变红,证明Na2SiO3发生了水解反应 | |
| B. | 将铝箔在酒精灯火焰上加热,铝箔熔化但不滴落,证明氧化铝熔点高于铝 | |
| C. | 向HClO溶液中通入SO2,生成H2SO4,证明H2SO4的酸性比HClO强 | |
| D. | 将饱和氯水滴到蓝色石蕊试纸上,试纸先变红后褪色,证明氯水有漂白性 |
14.下列说法中正确的是( )
| A. | 常温下pH=7的溶液中:Fe3+,Mg2+,SO42-,Cl-能大量共存 | |
| B. | 常温下水电离出c(H+)×c(OH-)=10-10的溶液中:Na+,NH4+,CH3COO-,F-不能大量共存 | |
| C. | 在含有HCO3-,HSO3-,CH3COO-,S2-四种阴离子的溶液中加入足够的Na2O2固体后,S2-浓度变化最小 | |
| D. | SO2,O2,HCl,CO2四种气体,可以大量共存于同一容器中 |
1.下列说法正确的是( )
| A. | 在光照条件下,甲烷与氯水发生取代反应 | |
| B. | 有机反应中,卤代、硝化、磺化、酯化、水解反应等不完全是取代反应 | |
| C. | 乙醇可与水以任意比例混溶,是因为与水形成了氢键 | |
| D. | 若烃中碳、氢元素的质量分数相同.它们必定是同系物 |

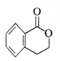
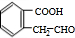
 +H2O$→_{△}^{稀H_{2}SO_{4}}$
+H2O$→_{△}^{稀H_{2}SO_{4}}$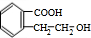 +CH3OH③F→G:2
+CH3OH③F→G:2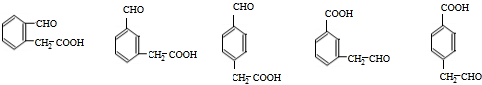 等
等