题目内容
【题目】用图所示实验装置可以完成中学化学实验中的一些实验。
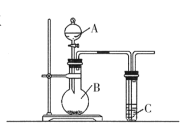
(1)现有稀硝酸、稀盐酸、稀硫酸、碳酸钠粉末、硅酸钠溶液五种试剂。选择三种试剂利用如图装置证明酸性强弱:H2SO4 > H2CO3 > H2SiO3
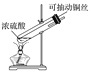
①仪器B的名称________,A中试剂________,B中试剂________
②C中发生反应的化学方程式:________________________________
(2)利用如图装置实验,证明二氧化硫气体具有漂白性。已知:Na2SO3 + H2SO4=Na2SO4 +SO2↑+H2O。 在装置A中加入 70%的硫酸溶液,B中加入Na2SO3粉末,
①C中应加入________溶液(填“品红”或“石蕊”)。打开分液漏斗活塞,一段时间后观察到C中现象是________________________________,反应完全后,将C试管加热一 段时间发生的现象是________________________
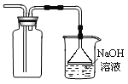
②如果仅用如图装置进行此实验,可能造成环境污染,此污染属于________(选填“白色污染”或“酸雨污染"),因此应该在C装置后加一个盛有________溶液的洗气瓶。
③将二氧化硫气体通入FeCl3溶液中反应一.段时间后,滴加KSCN溶液,溶液未变红色,请写出所发生反应的离子方程式:________________________________
【答案】圆底烧瓶 稀硫酸 碳酸钠粉末 CO2+H2O+Na2SiO3=H2SiO3↓+Na2CO3 品红 红色溶液褪色 红色恢复 酸雨污染 NaOH SO2+2Fe3++2H2O=Fe2++SO42-+4H+
【解析】
(1)强酸可以制弱酸,所以稀硫酸与碳酸钠粉末反应生成二氧化碳可证明酸性::H2SO4 > H2CO3 ;二氧化碳与硅酸钠溶液反应可生成硅酸沉淀说明酸性:H2CO3 > H2SiO3;
(2)装置A中加入 70%的硫酸溶液,B中加入Na2SO3粉末,二者反应生成SO2,SO2可以使品红溶液褪色,所以装置C中盛放品红溶液可以检验SO2;二氧化硫会对空气造成污染,需要处理,其可与NaOH溶液反应,所以可用NaOH溶液吸收。
(1)①根据仪器B的结构特点可知其为圆底烧瓶;根据分析可知A中应盛放稀硫酸;B中应盛放碳酸钠粉末;
②C中为二氧化碳与硅酸钠的反应,方程式为:CO2+H2O+Na2SiO3=H2SiO3↓+Na2CO3;
(2)①品红溶液可以检验二氧化硫,所以C中应加入品红溶液,可观察到C中红色溶液褪色;完全反应后将C试管加热一段时间可观察到C中溶液颜色恢复;
②二氧化硫会造成酸雨,所以属于酸雨污染;可用NaOH溶液吸收二氧化硫;
③二氧化硫具有还原性,通入FeCl3溶液中反应一段时间后,滴加KSCN溶液,溶液未变红色,说明Fe3+被还原成Fe2+,离子方程式为:SO2+2Fe3++2H2O=Fe2++SO42-+4H+。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案