题目内容
【题目】在一定条件下,将![]() 和
和![]() 置于一容积为2L的密闭容器中发生反应:
置于一容积为2L的密闭容器中发生反应:![]() ,反应过程中
,反应过程中![]() 、
、![]() 和
和![]() 的物质的量变化如下图:
的物质的量变化如下图:

(1)该反应化学平衡常数K的表达式为________。随着温度升高,平衡常数________(选填“增大”、“减小”或“不变”)。计算![]() 的平均反应速率
的平均反应速率![]() ________。
________。
(2)下列说法不能表明该反应达到平衡状态的是________。
a.容器内的压强不再变化 b.容器内气体的密度不再变化
c.![]() d.3mol H-H键断裂的同时,有6mol N-H键生成
d.3mol H-H键断裂的同时,有6mol N-H键生成
(3)0-10min、10-20min两个时间段内,![]() 的平均反应速率之比为________。在第10min可能改变的条件是__________________________________________。
的平均反应速率之比为________。在第10min可能改变的条件是__________________________________________。
(4)反应进行至25min时,曲线发生变化的原因是__________________________________________________.为使反应速率减小,且平衡向正反应方向移动,可采取的措施是________。
a.增大容器的体积 b.降低温度 c.使用催化剂
(5)在图中画出25min-40min时间段内![]() 的物质的量的变化图像(画在上图中)。__________________
的物质的量的变化图像(画在上图中)。__________________
【答案】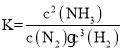 减小 0.0025mol/(L
减小 0.0025mol/(L![]() min) bcd 1:2 加入催化剂 减小氨气物质的量(或液化分离部分氨气等) b
min) bcd 1:2 加入催化剂 减小氨气物质的量(或液化分离部分氨气等) b 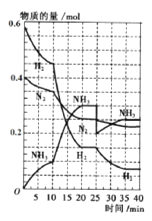
【解析】
(1)根据平衡常数的定义及影响因素作答;结合公式![]() 求解平均反应速率;
求解平均反应速率;
(2)反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度、百分含量不变,可以及由此衍生的一些量也不发生变化,由此进行判断;
(3)根据化学反应速率的定义式及化学反应速率与化学平衡的影响因素综合分析;
(4)根据化学反应速率与化学平衡的影响因素综合分析;
(5)
(1)对于反应![]() ,其平衡常数
,其平衡常数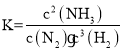 ;该反应为放热反应,因此升高温度,平衡常数减小;
;该反应为放热反应,因此升高温度,平衡常数减小;![]() 内
内![]() 从0.4mol降低到0.35mol,则平均反应速率
从0.4mol降低到0.35mol,则平均反应速率![]()
![]() =0.0025mol/(L
=0.0025mol/(L![]() min);
min);
(2)a. 一容积为2L的密闭容器中发生反应![]() ,则容器内的压强不再变化,说明反应达到动态平衡,a项正确;
,则容器内的压强不再变化,说明反应达到动态平衡,a项正确;
b. 反应中气体的总质量恒定不变,容器的体积不变,因此容器内气体的密度始终保持不变,则容器内气体的密度不再变化不能说明反应达到平衡状态,b项错误;
c. ![]() 不能说明v(正)与v(逆)的关系,因此不能作为判断平衡状态的标志,c项错误;
不能说明v(正)与v(逆)的关系,因此不能作为判断平衡状态的标志,c项错误;
d. 3mol H-H键断裂与6mol N-H键生成均代表正反应方向的速率,不能说明v(正)与v(逆)的关系,因此不能作为判断平衡状态的标志,d项错误;
故答案为:bcd;
(3)![]() 内
内![]() 从0.4mol降低到0.35mol,则平均反应速率
从0.4mol降低到0.35mol,则平均反应速率![]()
![]() =0.0025mol/(L
=0.0025mol/(L![]() min);
min);![]() 内
内![]() 从0.35mol降低到0.25mol,则平均反应速率
从0.35mol降低到0.25mol,则平均反应速率![]()
![]() =0.005mol/(L
=0.005mol/(L![]() min),则两者的速率之比为0.0025mol/(L
min),则两者的速率之比为0.0025mol/(L![]() min):0.005mol/(L
min):0.005mol/(L![]() min)=1:2,;根据图像可知,10min时,瞬间各物质的浓度均为变化,但10min后各物质反应的速率均增加,则在第10min可能改变的条件是加入了催化剂,故答案为:1:2;加入催化剂;
min)=1:2,;根据图像可知,10min时,瞬间各物质的浓度均为变化,但10min后各物质反应的速率均增加,则在第10min可能改变的条件是加入了催化剂,故答案为:1:2;加入催化剂;
(4)反应进行至25min时,曲线上NH3瞬间减小,则可能发生的改变是:减小氨气物质的量(或液化分离部分氨气等);![]() 为气体分子数减小的放热反应,则
为气体分子数减小的放热反应,则
a. 增大容器的体积,相当于减小体系压强,则反应速率减小,但平衡向逆反应方向移动,与题意不符,a项错误;
b. 降低温度,化学反应速率会减小,同时平衡会向正反应方向移动,符合题意,b项正确;
c.使用催化剂,化学反应速率会增大,且平衡不移动,不符合题意,c项错误;
故选b;
(5)因反应进行至25min时,减小了氨气的物质的量,则瞬间N2的物质的量不变,又平衡向正向移动,故N2在反应过程中会减小,25min -40min阶段,其减小量与氢气的减小量之比等于化学计量数之比,故![]() =1:3,图中
=1:3,图中![]() =0.15mol-0.075mol=0.075mol,故
=0.15mol-0.075mol=0.075mol,故![]() =
=![]() =0.025mol,反应到40min时,N2的物质的量减小到0.25mol-0.025mol=0.225mol,故
=0.025mol,反应到40min时,N2的物质的量减小到0.25mol-0.025mol=0.225mol,故![]() 的物质的量的变化图像如图:
的物质的量的变化图像如图: 。
。

【题目】某小组同学欲通过实验验证氯元素的非金属性强于硫元素。
(1)他们将过量硫粉与少量铁粉混合后隔绝空气加热,制得并分离出固体产物A。请帮他们完成实验报告。
实验步骤和操作 | 实验现象 | 实验结论或解释 |
①取少量A于试管中,加入足量稀硫酸 | 固体完全溶解,产生有臭鸡蛋气味的气体B | 硫粉与铁粉混合后隔绝空气加热,制得固体产物A是__________(填化学式) |
②将B通入足量水中 | 得到无色溶液C | |
③向①的试管中加入KSCN溶液 | 溶液无明显变化 | |
④将浓盐酸滴到KMnO4固体上 | 产生黄绿色气体 | 反应生成氯气 |
⑤将红热的铁丝(少量)伸入上述黄绿色气体中 | 铁丝剧烈燃烧,产生大量棕黄色的烟 | 反应的化学方程式为__________ |
⑥将⑤中所得固体产物溶于水,在所得溶液中滴加KSCN溶液 | 观察到___________(填现象) |
(2)综合上述实验现象和结论,___________(填“能”或“不能”)验证氯元素的非金属性强于硫元素,理由是_____________________________________。
(3)某同学将上述实验中④所得氯气直接通入无色溶液C中,观察到产生淡黄色固体,反应的化学方程式为_______________,此实验______________(填“能”或“不能”)验证氯元素的非金属性强于硫元素。
(4)某同学认为将步骤①中的稀硫酸换成稀盐酸,若同样产生有臭鸡蛋气味的气体B,则可以说明氯元素的非金属性强于硫元素,他的观点____________(填“正确”或“错误”),原因是_____________。
(5)现有四种试剂:A.新制的Cu(OH)2;B.浓硝酸;C.AgNO3溶液;D.碘水。为了鉴别下列三瓶无色溶液,请你选择合适的试剂,将其序号填入相应的括号中。(每个小题只有一个正确答案):
①葡萄糖溶液_____________②淀粉溶液_____________③鸡蛋清溶液____________。