题目内容
【题目】根据元素周期表和元素周期律,下列叙述正确的是( )
A.在周期表金属与非金属分界处寻找用于研制新农药的元素
B.H2、D2、T2互为同位素
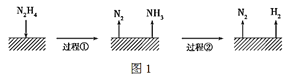
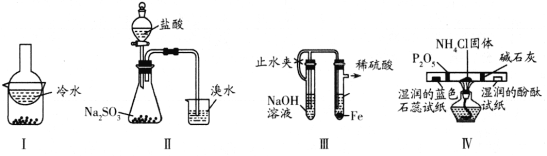
C.如图所示实验可证明元素的非金属性:Cl>C>Si
D.用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
【答案】D
【解析】
A.在周期表中金属和非金属元素的分界线附近可以寻找制取半导体的材料,在非金属部分寻找用于研制新农药的元素,故A错误;
B.H2、D2、T2都是氢气分子,不是原子,不能称为同位素,故B错误;
C.利用最高价含氧酸的酸性可以比较非金属性,HCl不是最高价含氧酸,则不能比较Cl、C的非金属性,故C错误;
D.118号元素的原子结构中有7个电子层、最外层电子数为8,则第118号元素在周期表中位于第七周期0族,故D正确;
故选D。

练习册系列答案
相关题目
【题目】已知反应2CH3OH(g)=CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
(1)比较此时正、逆反应速率的大小:v(正)____v(逆)(填“>”“<”或“=”)。
(2)若加入CH3OH后,经10min反应达到平衡,此时CH3OH的转化率__ ,该时间内反应速率v(CH3OH)=____ mol·L-1·min-1。