题目内容
【题目】食醋(主要成分CH3COOH )、纯碱(Na2CO3 )和小苏打(NaHCO3 )均为家庭厨房中常用的物质。已知:CH3COOH、H2CO3、HNO2的电离常数(25℃)分别为Ka=1.8×10-5;Ka1=4.3×10-7、Ka2=5.6×10-11;Ka=5.0×10-4请回答下列问题:
⑴一定温度下,向0.1mol/LCH3COOH 溶液中加入少量CH3COONa 晶体时,下列说法正确的是____(填代号。)
a.溶液的pH增大 b.CH3COOH的电离程度增大
c.溶液的导电能力减弱 d.溶液中c(OH-)·c(H+)不变
⑵25℃时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中:
c(CH3COO-)/c(CH3COOH)=____
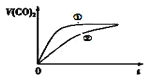
⑶常温下,将20mL 0.1mol/L CH3COOH溶液 和20mL 0.1mol/LHNO2 溶液分别与 20mL 0.1mol/LNaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示,则表示CH3COOH溶液的曲线是_______(填写序号);
⑷体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示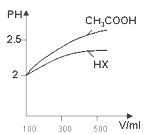 ,则HX的电离平衡常数______(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
,则HX的电离平衡常数______(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
⑸25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3·H2O的电离常数Kb =___________
【答案】ad 18 ② 小于 1.8×10-5
【解析】
(1)一定温度下,CH3COONa抑制 CH3COOH 电离;Kw=c(OH-)·c(H+),水的离子积常数只与温度有关;
(2)根据醋酸的电离平衡常数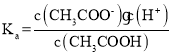 分析c(CH3COO-)/c(CH3COOH)的值;
分析c(CH3COO-)/c(CH3COOH)的值;
(3)氢离子浓度越大,反应速率越快;
(4)pH相等的酸中,加水稀释促进弱酸电离,稀释相同的倍数,pH变化大的酸性强,变化小的酸性弱;
(5)25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,恰好完全反应生成氯化铵,溶液的pH=7,说明醋酸根离子和铵根离子水解程度相等。
(1)a.向0.1mol/L CH3COOH 溶液中加入少量CH3COONa 晶体,醋酸根离子浓度增大,醋酸电离平衡逆向移动,氢离子浓度减小,溶液的pH增大,故a正确;
b.CH3COONa抑制 CH3COOH 电离,加入醋酸钠晶体,CH3COOH的电离程度减小,故b错误;
c.CH3COONa是强电解质,加入CH3COONa,离子浓度增大,溶液的导电能力增强,故c错误;
d.Kw=c(OH-)·c(H+),水的离子积常数只与温度有关,温度不变,则溶液中c(OH-)·c(H+)不变,故d正确;
故选ad;
(2)醋酸的电离平衡常数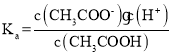 =1.8×10-5,所得混合液的pH=6,说明c(H+)=10-6,所以c(CH3COO-)/c(CH3COOH)=18;
=1.8×10-5,所得混合液的pH=6,说明c(H+)=10-6,所以c(CH3COO-)/c(CH3COOH)=18;
(3)氢离子浓度越大,反应速率越快,CH3COOH的电离常数小于HNO2,同浓度的CH3COOH和 HNO2,HNO2溶液中氢离子浓度大于CH3COOH,所以曲线②表示CH3COOH溶液;
(4)pH相等的酸中,加水稀释促进弱酸电离,稀释相同的倍数,pH变化大的为强酸,小的为弱酸,所以HX的酸性小于醋酸,则HX的电离平衡常数小于醋酸;
(5)25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,恰好完全反应生成氯化铵,溶液的pH=7,说明醋酸根离子和铵根离子水解程度相等,则醋酸和一水合氨电离程度相等,其电离平衡常数相等,即NH3·H2O的电离常数Kb=1.8×10-5mol/L。