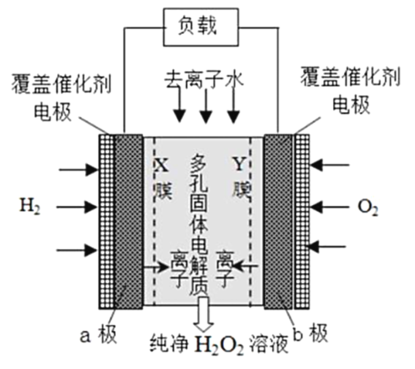
题目内容
【题目】下列依据热化学方程式得出的结论正确的是
A.已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1,则氢气的燃烧热为241.8kJ·mol-1
B.反应SO2(g)+2H2S(g)![]() 3S(s)+2H2O(l)在常温下能自发进行,则该反应的ΔH<0
3S(s)+2H2O(l)在常温下能自发进行,则该反应的ΔH<0
C.已知2C(s)+2O2(g)=2CO2(g) ΔH=a、 2C(s)+O2(g)=2CO(g) ΔH=b,则a>b
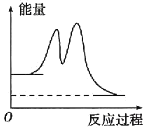
D.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
【答案】B
【解析】
A. 燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,氢气的燃烧热应生成液态水,气态水变为液态水还要放出热量,所以氢气燃烧热大于241.8 kJ·mol-1,A项错误;
B. 该反应的△S<0,常温下反应能够自发进行,说明△HT△S<0,所以必须有△H<0,B项正确;
C. 放热反应的△H<0,2molC(s)完全燃烧生成CO2(g)时放出的热量大于不完全燃烧生成CO(g)时放出的热量,放出的热量越多,焓变越小,则a<b,C项错误;
D. 物质所含能量越低越稳定,△H>0说明石墨变成金刚石是吸热反应,则说明等物质的量石墨的能量低于金刚石的能量,因此石墨比金刚石稳定,D项错误;
答案选B。

练习册系列答案
相关题目