题目内容
13.短周期元素A、B、C、D在周期表中的位置关系如图所示.已知在同周期元素的常见简单离子中,D的离子半径最小,E是周期表中半径最小的原子| A | B | C | |
| D |
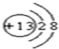
(1)C元素在元素周期表中的位置是第二周期第VIA 族.元素D的离子结构示意图为
(2)B、E两元素按原子数目比1:3和2:4构成分子X和Y,X的电子式为
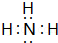 ,Y的结构式为
,Y的结构式为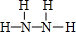 .
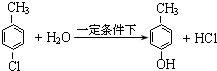
.(3)A、B、C元素的氢化物均有两种或两种以上.在一定条件下A2E4与E2C可发生反应,化学方程式为CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH.
(4)工业上冶炼单质D的化学反应方程式2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
(5)超细DB粉末被应用于大规模集成电路领域.其制作原理为D2C3、B2、A在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:l;其反应的化学方程式为Al2O3+N2+3C $\frac{\underline{\;高温\;}}{\;}$ 2AlN+3CO.
分析 由短周期主族元素A、B、C、D在周期表中的位置,可知A、B、C处于第二周期,D处于第三周期,在同周期元素的常见简单离子中,D的离子半径最小,则D为Al,可推知A为碳、B为氮、C为氧,E是周期表中半径最小的原子,则E为H元素,据此解答.
解答 解:由短周期主族元素A、B、C、D在周期表中的位置,可知A、B、C处于第二周期,D处于第三周期,在同周期元素的常见简单离子中,D的离子半径最小,则D为Al,可推知A为碳、B为氮、C为氧,E是周期表中半径最小的原子,则E为H元素.
(1)C为氧元素,在元素周期表中的位置是:第二周期第VIA 族,元素D为Al,离子结构示意图为  ,故答案为:第二周期第VIA 族;
,故答案为:第二周期第VIA 族; ;
;
(2)N、H两元素按原子数目比1:3和2:4构成分子X和Y,X为NH3,电子式为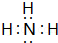 ,Y为N2H4,结构式为
,Y为N2H4,结构式为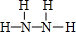 ,故答案为:
,故答案为: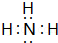 ;
;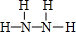 ;
;
(3)在一定条件下C2H4与H2O可发生反应生成乙醇,化学方程式为:CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH,故答案为:CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH;
(4)工业上电解熔融氧化铝冶炼单质Al,化学反应方程式为:2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑,故答案为:2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑;
(5)超细AlN粉末被应用于大规模集成电路领域.其制作原理为Al2O3、N2、碳在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:l,还生成CO,反应的化学方程式为:Al2O3+N2+3C $\frac{\underline{\;高温\;}}{\;}$ 2AlN+3CO,故答案为:Al2O3+N2+3C $\frac{\underline{\;高温\;}}{\;}$ 2AlN+3CO.
点评 本题考查结构性质位置关系应用,根据元素的位置推断元素是解题的关键,侧重对化学用语的考查,难度不大.

| A. | O原子的电子排布图为 | |
| B. | 氯化钠的分子式:NaCl | |
| C. | Cl-的结构示意图: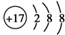 | |
| D. | Ca原子的电子排布式为 1s22s22p63s23p63d2 |
| A. | 在含有大量AlO2-的溶液中:NH4+、Na+、Cl-、H+ | |
| B. | 在强碱溶液中:Na+、K+、CO32-、NO3- | |
| C. | 常温下,在pH=12的溶液中:Mg2+、Na+、SO42-、Cl- | |
| D. | 在水电离出的c(H+)=1×10-13mol•L-1的溶液中:K+、I-、Cl-、NO3- |
| A. | NaHSO3溶液中投入过氧化钠粉末:4HSO3-+2Na2O2═4SO32-+O2↑+4Na+ | ||||||||
| B. | AlCl3溶液与烧碱溶液反应,当 n(OH-):n(Al3+ )=7:2时:2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | ||||||||
| C. | 钠与CuSO4溶液反应,2Na+Cu2+═Cu↓+2Na+ | ||||||||
| D. | 已知碳酸和次氯酸的电离平衡常数如下:
|
 MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中不正确的是( )
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中不正确的是( )| A. | ROH是一种强碱 | B. | 在x点,MOH并没有完全电离 | ||
| C. | 在x点,c(M+)=c(R+) | D. | 稀释前,c(ROH)=10c(MOH) |
 ,B
,B ,C
,C .
. ,②
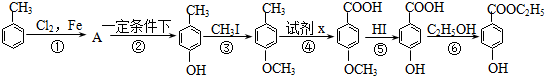
,② .
.
 .
. .
. .
. 已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示) .
.