题目内容
16.氢能源是一种重要的清洁能源.现有两种可产生H2的化合物甲和乙.将6.00g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72L H2(已折算成标准状况).甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液.化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25g/L.请回答下列问题:(1)甲的化学式是AlH3;乙的电子式是
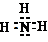 .
.(2)甲与水反应的化学方程式是AlH3+3H2O=Al(OH)3↓+3H2↑.
(3)气体丙与金属镁反应的产物是Mg3N2(用化学式表示).
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O.
(5)甲与乙之间可能发生反应产生H2,理由是AlH3中的H为-1价,NH3中的H为+1价,有可能发生氧化还原反应生成氢气.
分析 白色沉淀可溶于NaOH溶液,应为Al(OH)3,说明甲中含有Al和H两种元素,n(H2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,则m(H)=0.3mol×2×1g/mol=0.6g,则6.00g甲中含有m(Al)=6.00g-0.6g=5.4g,n(Al)=$\frac{5.4g}{27g/mol}$=0.2mol,所以n(Al):n(H)=0.2mol:0.6mol=1:3,则甲的化学式为AlH3,丙在标准状况下的密度为1.25g•L-1,则丙的相对原子质量为1.25g•L-1×22.4L=28,应为N2,则乙为NH3,结合对应的物质以及题目要求可解答该题.
解答 解:白色沉淀可溶于NaOH溶液,应为Al(OH)3,说明甲中含有Al和H两种元素,n(H2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,则m(H)=0.3mol×2×1g/mol=0.6g,则6.00g甲中含有m(Al)=6.00g-0.6g=5.4g,n(Al)=$\frac{5.4g}{27g/mol}$=0.2mol,所以n(Al):n(H)=0.2mol:0.6mol=1:3,则甲的化学式为AlH3,丙在标准状况下的密度为1.25g•L-1,则丙的相对原子质量为1.25g•L-1×22.4L=28,应为N2,则乙为NH3,
(1)由以上分析可知甲为AlH3,乙为NH3,电子式为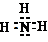
故答案为:AlH3;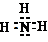
(2)AlH3与水发生氧化还原反应,反应的方程式为AlH3+3H2O=Al(OH)3↓+3H2↑,
故答案为:AlH3+3H2O=Al(OH)3↓+3H2↑;
(3)镁可在氮气中燃烧生成氮化镁,化学式为Mg3N2,
故答案为:Mg3N2;
(4)NH3在加热条件下与CuO反应可生成Cu和气体N2,反应的方程式为3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O,
故答案为:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O;
(5)AlH3中的H为-1价,NH3中的H为+1价,从化合价的角度可知二者可能发生氧化还原反应生成氢气,
故答案为:AlH3中的H为-1价,NH3中的H为+1价,有可能发生氧化还原反应生成氢气.
点评 本题考查无机物的推断,题目难度不大,注意根据先关反应的现象以及数据判断甲乙两种物质,注意相关反应的化学方程式的书写.

| A. | 小于$\frac{1}{2}$ | B. | 大于$\frac{1}{2}$,小于1 | C. | 等于$\frac{1}{2}$ | D. | 大于1,小于2 |
| A. | 无水硫酸铜 | B. | 浓硫酸 | C. | 新制的生石灰 | D. | 氢氧化钙 |
| A. | 二氧化硅的结构式:O=Si=O | |
| B. | H2O沸点高于NH3,是因为H2O分子间存在氢键而NH3分子间不存在氢键 | |
| C. | 含有金属离子的晶体一定是离子晶体 | |
| D. | 分子晶体中一定存在分子间作用力,不一定存在共价键 |
| A. | 金属钠着火,立即用泡沫灭火器灭火 | |
| B. | 眼睛里溅进盐酸,应立即用大量水冲洗眼睛 | |
| C. | 易燃试剂与强氧化性试剂分开放置并远离火源 | |
| D. | 在气体发生装置上直接点燃氢气时,必须先检验氢气的纯度 |
| A. | n1=n2 | B. | n1>n2 | C. | n1<n2 | D. | c(A-)<c(B-) |
| A. | 溶液中NaOH的物质的量 | B. | 溶液中Na+的物质的量浓度 | ||
| C. | 溶液中Na+的数目 | D. | 溶液的质量 |
 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.请回答下列问题: