题目内容
6.氨是一种重要的基础化工原料,可以生产硝酸等一系列化工产品.德国人哈伯在1905年发明的合成氨反应原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ/mol请回答下列问题:
(1)该反应属于放热反应(“放热”或“吸热”),将10molN2和30molH2装入密闭容器中,在一定条件下反应达到平衡,若有20%的N2转化,则反应放出的热量是184.8kJ.当温度升高时该反应的平衡常数会减小(填“增大”或“减小”).
(2)一定条件下的密闭容器中,反应达到平衡,要提高H2的转化率,可以采取的措施是ae.
a.向体系中通入N2 b.加入催化剂
c.向体系中通入惰性气体 d.向体系中通入NH3 e.降低温度
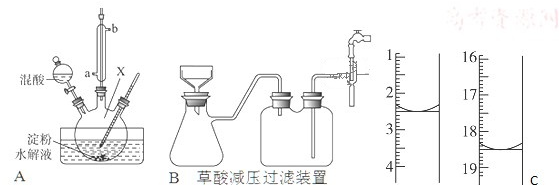
(3)用如图甲所示装置(夹持固定装置已略去)在实验室中模拟用NH3制备HNO3的过程:回答下列问题:

①实验时,A装置中盛放的试剂是NH4Cl和Ca(OH)2;装置B中反应的化学方程式为4NH3+5O2$?_{加热}^{催化剂}$4NO+6H2O;
②C装置中盛放的试剂是P2O5;该物质主要作用是吸收H2O和NH3;D装置的作用是安全瓶的作用;
③若将如图甲所示装置中虚线部分换成图乙所示装置进行实验.反应开始前,分液漏斗中盛放的药品是H2O2;烧瓶中盛放的药品是浓氨水和MnO2.
分析 (1)△H<0为放热反应,将10molN2和30molH2装入密闭容器中,在一定条件下反应达到平衡,若有20%的N2转化,即有2molN2参加反应,根据热化学方程式计算出放出的热,根据温度对平衡移到的影响判断平衡常数的变化;
(2)在可逆反应中要提高一种反应物的转化率可以增加另外一种反应的物的浓度,或通过改变外界条件使平衡向正反应方向移动;
(3)实验室中模拟用NH3制备HNO3,用如图甲所示装置过程为用氯化铵与氢氧化钙反应生成氨气,再通入空气,在B装置中通过催化剂、加热,氨气氧化成一氧化氮,C装置干燥一氧化氮,同时除去未反应的氨气,可以用酸性干燥剂,D装置作安全瓶,E装置中一氧化氮、氧气与水反应生成硝酸,F装置用氢氧化钠溶液吸收未反应的氮的氧化物,如果改成乙图制氨气同时要提供氧气,可以用双氧水在二氧化锰作用下产生氧气,用浓氨水挥发产生氨气,据此答题.
解答 解:(1)△H<0为放热反应,将10molN2和30molH2装入密闭容器中,在一定条件下反应达到平衡,若有20%的N2转化,即有2molN2参加反应,根据热化学方程式N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ/mol可知,产生的热量为184.8kJ的热量,升高温度时,平衡向逆反应方程移动,平衡常数的减小,
故答案为:放热;184.8kJ;减小;
(2)合成氨的反应为气体体积减小的放热反应,a.向体系中通入N2,可以提高氢气的转化率; b.加入催化剂,对平衡移动没有影响,所以对氢气的转化率也没有影响;c.向体系中通入惰性气体,各物质浓度不变,对平衡移动没有影响,所以对氢气的转化率也没有影响; d.向体系中通入NH3,平衡逆向移动,不能提高氢气的转化率; e.降低温度,平衡正向移动,可以提高氢气的转化率,
故选:a e;
(3)实验室中模拟用NH3制备HNO3,用如图甲所示装置过程为用氯化铵与氢氧化钙反应生成氨气,再通入空气,在B装置中通过催化剂、加热,氨气氧化成一氧化氮,C装置干燥一氧化氮,同时除去未反应的氨气,可以用酸性干燥剂,D装置作安全瓶,E装置中一氧化氮、氧气与水反应生成硝酸,F装置用氢氧化钠溶液吸收未反应的氮的氧化物,
①根据上面的分析可知,A装置中盛放的试剂是 NH4Cl 和Ca(OH)2;装置B中反应为氨的催化氧化,反应的化学方程式为 4NH3+5O2 $?_{加热}^{催化剂}$ 4NO+6H2O,
故答案为:NH4Cl 和Ca(OH)2;4NH3+5O2 $?_{加热}^{催化剂}$ 4NO+6H2O;
②根据上面的分析可知,C装置干燥一氧化氮,同时除去未反应的氨气,可以用酸性干燥剂,常见的酸性干燥剂为P2O5,该物质主要作用是 吸收H2O和NH3;D装置的作用是安全瓶,
故答案为:P2O5;吸收H2O和NH3;安全瓶的作用;
③如果改成乙图制氨气同时要提供氧气,可以用双氧水在二氧化锰作用下产生氧气,用浓氨水挥发产生氨气,所以反应开始前,分液漏斗中盛放的药品是H2O2,烧瓶中盛放的药品是浓氨水和MnO2,
故答案为:H2O2;浓氨水和MnO2.
点评 本题主要考查了反应热、化学平衡的影响因素、氨气的催化氧化,解答须根据题目中提供的药品和装置结合该反应的原理和相关物质的性质,题目难度中等.

| A. | 化学反应分为:氧化还原反应、非氧化还原反应(标准:有没有单质参加或生成) | |
| B. | 分散系分为:溶液、胶体、浊液(标准:有没有丁达尔效应) | |
| C. | 化学反应分为:化合反应、分解反应、置换反应、复分解反应(标准:按反应物和生成物的类别以及反应前后物质种类的多少) | |
| D. | 无色的溶液:CO32-、SO42-、Cu2+、NH4+ |
| A. | S(g)+O2(g)═SO2(g)△H1;S(s)+O2═SO2(g)△H2,则△H1>△H2 | |
| B. | C(石墨,s)═C(金刚石,s)△H=+1.9kJ•mol-1,则金刚石比石墨稳定 | |
| C. | OH-(aq)+H+(aq)=H2O(l)△H=-57.4kJ•mol-1,则:含20gNaOH的稀溶液与过量稀醋酸完全反应,放出的热量为28.7kJ | |
| D. | 2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1,则碳的燃烧热大于110.5kJ•mol-1 |
| A. | 2mol | B. | 3mol | C. | 4mol | D. | 5mol |
(1)请完成下表:
| 甲同学 | 乙同学 | |
| 选用试剂 | A1C13溶液、NaOH溶液 | A12(SO4)3溶液、氨水 |
| 操作 | 向AlCl3溶液中逐滴加入NaOH溶液至过量 | 向A12(SO4)3溶液中逐滴加入氨水至过量 |
| 实验现象 | 先产生白色沉淀,然后沉淀逐渐消失 | |
| 化学方程式 | AlCl3+3NaOH=Al(OH)3↓+3NaClAl(OH)3+NaOH=NaAlO2+2H2O | A12(SO4)3+6NH3•H2O═2A1(OH)3↓+3(NH4)2SO4 |
| 离子方程式 | Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O | Al3++3NH3•H2O=Al(OH)3↓+3NH4+ |
(3)由甲、乙两同学的实验现象你能得出的结论有(用简要文字说明)实验室制取氢氧化铝最好选用可溶性铝盐和氨水,氢氧化铝可以和氢氧化钠溶液发生反应,和一水合氨不发生反应.
 二氧化碳是造成温室效应的主要气体,二氧化碳的回收再利用是减缓温室效应的有效途径之一.
二氧化碳是造成温室效应的主要气体,二氧化碳的回收再利用是减缓温室效应的有效途径之一.(1)二氧化碳重整可用于制取甲烷,已知:
CH4(g)+CO2(g)?2CO(g)+2H2(g)△H1=+247kJ•mol-1
CH4(g)+H2O(g)?CO(g)+3H2(g)△H2=+205kJ•mol-1
则反应CO2(g)+4H2(g)?CH4(g)+2H2O(g)的△H3=-163kJ/mol.
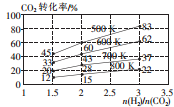
(2)一定压强下,在某恒容密闭容器中,充入H2和CO2发生反应:
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),其起始投料比、温度与CO2的转化率的关系如图所示.
①降低温度,平衡向逆反应 方向移动.
②在700K,起始投料比$\frac{n({H}_{2})}{n(C{O}_{2})}$=1.5时,H2 的转化率为40%.
(3)CO2和H2在一定条件下可合成二甲醚:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H.在一定压强下,将2.5molH2与a molCO2置于容积为1L的密闭容器中,发生上述反应,达到平衡状态时,测得反应的实验数据如下表:
| 温度/K CO2转化率/% a/mol | 500 | 600 | 700 | 800 |
| 1.67 | x | 33 | ||
| 1.25 | 60 | 43 | y | |
| 0.83 | z | 32 | w |
A.x=y B.x>y C.x<y D.无法判断
②下列关于该反应叙述正确的是ABC
A.该反应的△H<0,△S<0
B.该反应的平衡常数随温度升高而减小
C.转化率分别为z、w时,达到平衡的时间前者长
D.转化率分别为y、w时,平衡常数不同.

 .
.