题目内容
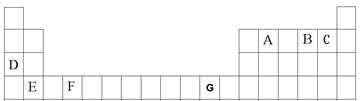
下表为元素周期表的一部分,a、b、c…为部分元素。回答下列问题:
(1)请写出上述元素d3+的核外电子排布式 ;
(2)请写出e元素的原子价电子轨道表示式 ;
(3)ya3分子的电子式是 ,其分子的空间构型是 ,
(4)b、e两种元素中,金属性较强的是 ;第一电离能大的是_______.(填元素符号)
(5)h的i形成hi2分子杂化类型是________ fh3-的空间构型分别为_______________
| a | | | |||||||||||||||
| | | | | f | y | h | i | | |||||||||
| | b | | e | | | | j | | |||||||||
| c | | | | | | | d | | d | | g | | l | | | | |
| | | | | | | | | | | | | | | | | | |
(2)请写出e元素的原子价电子轨道表示式 ;
(3)ya3分子的电子式是 ,其分子的空间构型是 ,
(4)b、e两种元素中,金属性较强的是 ;第一电离能大的是_______.(填元素符号)
(5)h的i形成hi2分子杂化类型是________ fh3-的空间构型分别为_______________
(1)1s222s2p63s23p63d5 (2)略(3) 三角锥形
(4)Mg、 Mg (5)SP3 平面正三角形(每空1分)
(4)Mg、 Mg (5)SP3 平面正三角形(每空1分)
略

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 b
b  c
c 
 点如右图,则该化合物的化学式为 ; C、Ni、Mg三种元素中,电负性最大的是 。
点如右图,则该化合物的化学式为 ; C、Ni、Mg三种元素中,电负性最大的是 。

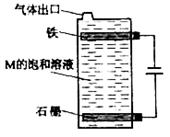
 出来的相对分子质量大一些,其原因是: 。
出来的相对分子质量大一些,其原因是: 。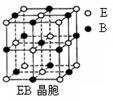

 ________________________________________________。
________________________________________________。
 ________HClO4
________HClO4