题目内容
在物质结构研究的历史上,通过α粒子散射实验,提出原子结构有核模型的是:
| A.道尔顿 | B.卢瑟福 | C.汤姆生 | D.波尔 |
B
本题属于识记题。1808年,英国科学家道尔顿提出了原子论; 1897年,英国科学家汤姆生发现原子中存在电子。1904年汤姆生提出了一个被称为“西瓜式”结构的原子结构模型;1911年英国科学家卢瑟福做了一个实验:用一束质量比电子大很多的带正电高速运动的粒子轰击金箔,结果是大多数粒子能穿过金箔且不改变原来的前进方向,但也有一小部分改变了原来的方向,还有极少数的粒子被反弹了回来。据此他提出了带核的原子结构模型:原子由由原子核和核外电子构成。故正确答案为B。

练习册系列答案
 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
 ;
;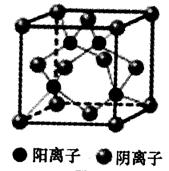
 实验,它是锗酸铋的简称。若知:①在BGO中,锗处于其最高价态。②在BGO中,铋的价态与铋跟氯形成某种共价氯化物时所呈的价态相同,在此氯化物中铋具有最外层8个电子稳定结构。③BGO可看成是由锗和铋两种元素的氧化物所形成的复杂氧化物,且在BGO晶体的化学式中,这两种氧化物所含氧的总质量相同。
实验,它是锗酸铋的简称。若知:①在BGO中,锗处于其最高价态。②在BGO中,铋的价态与铋跟氯形成某种共价氯化物时所呈的价态相同,在此氯化物中铋具有最外层8个电子稳定结构。③BGO可看成是由锗和铋两种元素的氧化物所形成的复杂氧化物,且在BGO晶体的化学式中,这两种氧化物所含氧的总质量相同。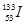 。下列有关叙述正确的是 ( )
。下列有关叙述正确的是 ( )