题目内容
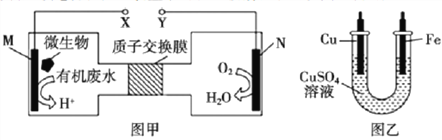
【题目】瑞典化学家舍勒将软锰矿(主要成分为MnO2)与浓盐酸混合加热,在世界上首先得到了氯气.已知Cl2和碱溶液在不同条件下,得到的产物不同,某兴趣小组用如图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质.
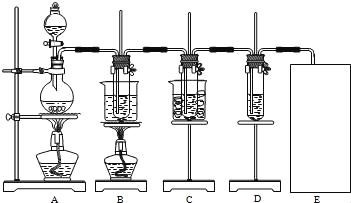
图中:A为氯气发生装置;B的试管里盛有15mL 30% KOH溶液,并置于水浴中;C的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;D的试管里盛有紫色石蕊试液.
请填写下列空白:
(1)制取氯气时,在圆底烧瓶里加入一定质量的二氧化锰,通过_____(填仪器名称)向圆底烧瓶中加入适量的浓盐酸.装置A中反应的离子方程式是_____.
(2)制取氯酸钾是在装置B中进行的,装置B中制取氯酸钾的化学反应方程式是____________.该小组同学发现制得的氯酸钾产量偏低,原因是氯气中含有杂质,改进方法是______.
(3)实验中装置D的试管中产生的现象是________.
(4)请在装置图方框中画出上述实验还缺少的装置,并注明试剂.________
(5)该小组同学认为:SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强.但是如果将SO2和Cl2同时通入到品红溶液中,则会发现褪色效果并不像该小组同学想象的那样.请你分析原因(用离子方程式表示)_______.
【答案】 分液漏斗 MnO2+4H++2Cl﹣![]() Mn2++Cl2↑+2H2O 3Cl2+6KOH
Mn2++Cl2↑+2H2O 3Cl2+6KOH![]() KClO3+5KCl+3H2O 在装置A、B之间加一个盛饱和食盐水的洗气瓶 溶液先变红后褪色
KClO3+5KCl+3H2O 在装置A、B之间加一个盛饱和食盐水的洗气瓶 溶液先变红后褪色 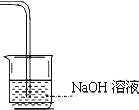 SO2+Cl2+2H2O=4H++SO42﹣+2Cl﹣
SO2+Cl2+2H2O=4H++SO42﹣+2Cl﹣
【解析】(1)制备氯气的原理是利用二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水,浓盐酸从分液漏斗中加入,反应的离子方程式为: MnO2+4H++2Cl﹣![]() Mn2++Cl2↑+2H2O(2)氯气与氢氧化钾在加热条件下生成氯化钾和氯酸钾和水,化学方程式: 3Cl2+6KOH
Mn2++Cl2↑+2H2O(2)氯气与氢氧化钾在加热条件下生成氯化钾和氯酸钾和水,化学方程式: 3Cl2+6KOH![]() KClO3+5KCl+3H2O
KClO3+5KCl+3H2O
,氯气中可能含有氯化氢气体,AB间增加一个洗气装置,可加一个盛饱和食盐水的洗气瓶,吸收氯化氢,避免产生误差。(3)氯气与水反应生成盐酸和次氯酸,既有酸性,又具有漂白性,能够使石蕊试液先变红色后褪色,(4)剩余的氯气不能排放到空气中,需要用氢氧化钠溶液吸收,装置图为 (5)SO2和Cl2按1:1通入, 两者恰好反应,生成H2SO4和HCl,生成物都无漂白性,化学方程式为:SO2+Cl2+2H2O=4H++SO42﹣+2Cl﹣
(5)SO2和Cl2按1:1通入, 两者恰好反应,生成H2SO4和HCl,生成物都无漂白性,化学方程式为:SO2+Cl2+2H2O=4H++SO42﹣+2Cl﹣