题目内容
【题目】工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJmol﹣1 , 将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).图中数据a(1,6)表示:在1min时H2的物质的量是6mol. 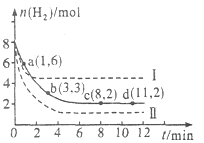
(1)a点正反应速率(填“大于”“等于”或“小于”)逆反应速率.
(2)下列时间段平均反应速率最大的是 .
A.O~1min
B.1~3min
C.3~8min
D.8~11min
(3)仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中所示(虚线).曲线I对应的实验条件改变是 , 曲线Ⅱ对应的实验条件改变是 , 体积不变再充入3molCO2和4mol H2 , H2O(g)的体积分数(填“增大”“不变”或“减小”).
(4)若将1molCO2和3molH2充入该容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为 .
【答案】
(1)大于
(2)A
(3)升高温度;增大压强;增大
(4)![]()
【解析】解:(1)a点时还没有达到平衡状态,反应物氢气的物质的量继续减小,平衡向正向移动,所以正反应速率大于逆反应速率,所以答案是:大于;(2)由图可知,
A.0~1min内氢气的变化量为8mol﹣6mol=2mol;
B.1~3min内氢气的变化量为6mol﹣3mol=3mol,平均1min变化量为1.5mol;
C.3~8min内氢气的变化量为3mol﹣2mol=1mol,平均1min变化量为0.2mol;
D.8~11min达平衡状态,氢气的物质的量不再变化.
故1~3min速率增大.
所以答案是:A;(3)曲线I反应速率增大,但转化的氢气的物质的量少,应是升高温度,因该反应放热,升高温度平衡逆向移动,不利于氢气的转化,故曲线I是升高温度;曲线Ⅲ反应速率增大,转化的氢气的物质的量多,因增大压强平衡正向移动,故应是增大压强,体积不变再充入3molCO2和4mol H2,相当于增大压强,平衡正向移动,则H2O(g)的体积分数增大,
所以答案是:升高温度;增大压强;增大;(4)在T1度时,将1molCO2和3molH2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为a,
CO2(g)+ | 3H2(g)= | CH2OH(g)+ | H2O(g) | |
起始(mol) | 1 | 3 | 0 | 0 |
转化(mol) | a | 3a | a | a |
平衡(mol) | 1-a | 3-3a | a | a |
容器内的压强与起始压强之比=(4﹣2a):4= ![]() ,
,
所以答案是: ![]() .
.
【考点精析】解答此题的关键在于理解化学平衡的计算的相关知识,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.

【题目】下表是元素周期表的一部分,针对表中的①~⑨九种元素,填写下列空白:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1)在这些元素中,化学性质最不活泼的是______(填元素符号),②位于元素周期表的第____纵行。
(2)这些元素的最高价氧化物的水化物中,碱性最强的化合物的电子式是___________。
(3)④的单质比⑨的单质熔点_______(填“高”或“低”),④⑤⑥⑦的简单离子半径由小到大的顺序为___________________(用序号表示)。
(4)①与⑦形成的某种化合物经常用作萃取剂,其结构式为________,该化合物属于________(填“共价”或“离子”)化合物。④与③形成的淡黄色的固体的阴、阳离子的个数比为_______。
(5)元素③与元素⑥相比,能证明这两种元素非金属性强弱的事实是_______(填选项序号)。
A.常温下③的单质和⑥的单质状态不同 B.③的简单氢化物比⑥的简单氢化物稳定
C.简单氢化物的沸点:③>⑥ D.③的单质能与⑥的简单氢化物反应生成⑥的单质