题目内容
8.元素周期表中有相邻元素A、B、C,A与B同周期,B与C同主族,它们的原子最外层电子数之和为19,原子序数之和为33,则( )| A. | B位于第二周期第ⅣA族 | |
| B. | A在同周期元素中原子半径最小 | |
| C. | A、B没有最高正化合价 | |
| D. | B、C所形成的化合物会引发温室效应 |
分析 A、B、C是周期表中相邻的三种元素,A、B同周期,B、C同主族,三种元素质子数之和为33,则A、B、C应在周期表中前三周期;设B的质子数为x,则A的质子数为x+1或x-1,C的质子数为x+8或x-8,根据质子数之和为33有,有下列四种情况:
①x+x-1+x-8=33,此时x=14,则A为铝元素,B为硅元素,C为碳元素,三者的最外层电子数为:3+4+4=11,不符合题意;
②x+x-1+x+8=33,此时x=$\frac{26}{3}$,不符合题意;
③x+x+1+x-8=33,此时x=$\frac{40}{3}$,不符合题意;
④x+x+1+x+8=33,此时x=8,则A为氟元素,B为氧元素,C为硫元素,由于最外层电子数之和为:7+6+6=19,符合题意,然后结合元素周期律知识进行判断.
解答 解:A、B、C是周期表中相邻的三种元素,A、B同周期,B、C同主族,三种元素质子数之和为33,则A、B、C应在周期表中前三周期;设B的质子数为x,则A的质子数为x+1或x-1,C的质子数为x+8或x-8,根据质子数之和为33有,有下列四种情况:
①x+x-1+x-8=33,此时x=14,则A为铝元素,B为硅元素,C为碳元素,三者的最外层电子数为:3+4+4=11,不符合题意;②x+x-1+x+8=33,此时x=$\frac{26}{3}$,不符合题意;③x+x+1+x-8=33,此时x=$\frac{40}{3}$,不符合题意;④x+x+1+x+8=33,此时x=8,则A为氟元素,B为氧元素,C为硫元素,由于最外层电子数之和为:7+6+6=19,符合题意,
A.B为O元素,原子序数为8,位于周期表中第二周期ⅥA族,故A错误;
B.A为F元素,F元素在第二周期中原子半径最小,故B正确;
C.A为F、B为O元素,二者都没有正化合价,故C正确;
D.B、C形成的化合物为二氧化硫,二氧化硫会造成酸雨,不是温室效应,故D错误;
故选BC.
点评 本题考查了位置、结构与性质关系的应用,题目难度中等,根据题干信息正确推断各元素名称为解答关键,试题侧重考查学生的分析、理解能力,注意掌握原子结构与元素周期律的关系.

| A. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=-485KJ/mol | B. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+485KJ/mol | ||
| C. | 2 H2(g)+O2(g)═2 H2O(g)△H=+485KJ/mol | D. | 2 H2(g)+O2(g)═2 H2O(g)△H=-485KJ/mol |
| A. | 第3周期金属元素最高价氧化物对应的水化物,其碱性随原子序数的增大而减弱 | |
| B. | 砹(At)是第ⅦA族元素,其氢化物的稳定性大于HCl | |
| C. | 第2周期非金属元素的气态氢化物溶于水后,水溶液均为酸性 | |
| D. | 铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应 |
| A. | 通过足量溴水 | |
| B. | 通入足量的酸性高锰酸钾溶液 | |
| C. | 燃烧 | |
| D. | 使乙炔在一定条件下与氢气发生加成反应 |
①都是银白色的柔软金属(除铯外),密度都比较小
②单质在空气中燃烧生成的都是过氧化物
③碱金属单质都与水剧烈反应
④单质的熔、沸点随着原子序数的增加而升高.
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
| A. | 在世博园区进行大规模绿化建设,提高绿化面积 | |
| B. | 建立空调凝结水和屋面雨水收集系统,充分利用水资源 | |
| C. | 将世博园区的垃圾收集起来进行集中焚烧处理 | |
| D. | 在建筑、布展、运营过程中应用大规模的太阳能光伏发电系统 |
| A. | ①②③④⑤ | B. | ⑤④③①② | C. | ②④③①⑤ | D. | ③④②①⑤ |
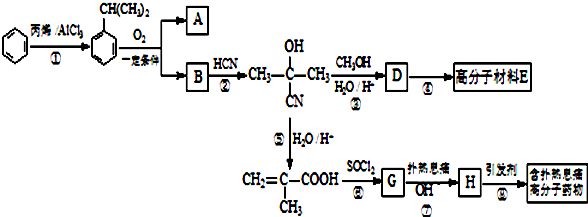

 可转化为1mol A和1molB,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式:
可转化为1mol A和1molB,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式: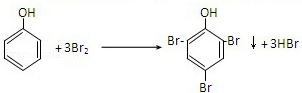 ;
;  ;扑热息痛的结构简式为
;扑热息痛的结构简式为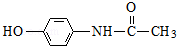 .
.