题目内容
9.某同学对铜与浓硫酸反应产生的黑色沉淀进行探究,实验步骤如下:Ⅰ.将光亮铜丝插入浓硫酸,加热;
Ⅱ.待产生黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
(1)甲同学认为根据所学知识:已知硫化铜(CuS)、硫化亚铜(Cu2S)、粉末和氧化铜粉末相似且都不溶于水,在空气中煅烧硫化铜和硫化亚铜都转化二种氧化物,设计一个不用任何化学试剂就能鉴别氧化铜、硫化铜、硫化亚铜三种粉末的简便实验方案,请帮助甲同学将方案填写于下表中,实验提供天平及其他必要的设备.
| 实验步骤 | 实验现象 | 结论及有关化学方程式 |
| A.分别称取相同质量的样品,在空气中燃烧; B.分别称量硫化铜和硫化亚铜灼烧后剩余物质的质量 | A.有一种固体无变化,两种固体产生刺激性气味气体 B.有一种样品质量减轻,一种样品质量不变 | A.固体无变化的是氧化铜,产生刺激性气味气体的是硫化铜和硫化亚铜,在空气中煅烧中反应的化学方程式分别为2CuS+3O2 $\frac{\underline{\;\;△\;\;}}{\;}$2CuO+2SO2; Cu2S+2O2 $\frac{\underline{\;\;△\;\;}}{\;}$2CuO+SO2 B.质量减轻的是硫化铜,质量不变的是硫化亚铜 |
①将CuO放入稀硫酸中,一段时间后,再滴加K4[Fe(CN)6]溶液,产生红褐色沉淀.
②将黑色沉淀放入稀硫酸中,一段时间后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀.
由该检验过程所得结论是黑色沉淀中不含有CuO.
(3)丙同学再次假设,黑色沉淀是铜的硫化物.实验如下:
| 实验装置 | 现象 |
 | 1.A试管中黑色沉淀逐渐溶解 2.A试管内上方出现红棕色气体 3.B试管中出现白色沉淀 |
②能确认黑色沉淀中含有S元素的现象是B试管中出现白色沉淀,相应的离子方程式是NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+.
③为确认黑色沉淀是“铜的硫化物”,还需进行的实验操作是取冷却后A装置试管中的溶液,滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+,说明黑色沉淀是铜的硫化物.
以上实验说明,黑色沉淀中存在铜的硫化物.进一步实验后证明黑色沉淀是CuS与Cu2S的混合物.将黑色沉淀放入浓硫酸中加热一段时间后,沉淀溶解,其中CuS溶解的化学方程式是CuS+4H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+4SO2↑+4H2O.
(4)丁同学通过实验确认,固体只含有硫化铜和硫化亚铜,他通过以下实验求硫化亚铜的百分含量:取2g Cu2S和CuS的混合物在酸性溶液中用400mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350mL 0.1mol/L(NH4)2Fe(SO4)2溶液完全反应.
则混合物中Cu2S的质量分数为40%.
分析 (1)在空气中煅烧硫化铜和硫化亚铜都转化为氧化铜和二氧化硫,有刺激性气味的气体产生,而氧化铜受热无变化,由于硫化铜和硫化亚铜的含铜量不同,故剩余的生成氧化铜的质量不同,然后根据物质的质量差异进行鉴别;
(2)根据题中信息中检验铜离子的方法对②进行分析,然后得出正确结论;
(3)①红棕色气体为二氧化氮,说明稀硝酸被还原生成一氧化氮,黑色固体具有还原性;
②根据反应现象③可知黑色固体与稀硝酸反应生成了二氧化硫,证明黑色固体中含有硫元素;二氧化氮、二氧化硫的混合气体能够与氯化钡反应生成硫酸钡沉淀,据此写出反应的离子方程式;
③还需要确定黑色固体中含有铜离子,根据题目信息来解答;浓硫酸具有强氧化性,能够将硫化铜中硫氧化成硫酸铜、二氧化硫和水,据此写出反应的化学方程式;
(4)先根据方程式MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O计算消耗的高锰酸钾的物质的量;高锰酸钾的总物质的量减去与(NH4)2Fe(SO4)2 反应的高锰酸钾的物质的量即为与混合溶液反应消耗的高锰酸钾的物质的量;
再根据金属化合物的质量和金属化合物与高锰酸钾反应的高锰酸钾的物质的量列方程式组,计算出硫化亚铜的质量,最后根据质量分数计算方法计算即可.
解答 解:(1)在空气中煅烧硫化铜和硫化亚铜都转化为氧化铜和二氧化硫,有刺激性气味的气体产生,而氧化铜受热无变化,由于硫化铜和硫化亚铜的含铜量不同,故剩余的生成氧化铜的质量不同,可以分别称量硫化铜和硫化亚铜灼烧后剩余物质的质量进行鉴别,如
2CuS+3O2 $\frac{\underline{\;\;△\;\;}}{\;}$2CuO+2SO2
192 160
Cu2S+2O2 $\frac{\underline{\;\;△\;\;}}{\;}$2CuO+SO2
160 160
故答案为:2CuS+3O2 $\frac{\underline{\;\;△\;\;}}{\;}$2CuO+2SO2;Cu2S+2O2 $\frac{\underline{\;\;△\;\;}}{\;}$2CuO+SO2;分别称量硫化铜和硫化亚铜灼烧后剩余物质的质量;
(2)向试液中滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+,根据②将黑色沉淀放入稀硫酸中,一段时间后,滴加K4[Fe(CN)6]溶液,未见红褐色沉淀可知,黑色固体中一定不含CuO,
故答案为:黑色沉淀中不含有CuO;
(3)①A试管内上方出现红棕色气体,说明反应中有一氧化氮生成,证明了黑色固体具有还原性,在反应中被氧化,故答案为:还原;
②根据反应现象③B试管中出现白色沉淀可知,白色沉淀为硫酸钡,说明黑色固体中含有硫元素;发生反应的离子方程式为:NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+,
故答案为:B试管中出现白色沉淀;NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+;
③为确认黑色沉淀是“铜的硫化物”,还需检验黑色固体中含有铜离子,方法为:取冷却后A装置试管中的溶液,滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+,说明黑色沉淀是铜的硫化物;浓硫酸具有强氧化性,硫化铜与浓硫酸反应的化学方程式为:CuS+4H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+4SO2↑+4H2O;
故答案为:取冷却后A装置试管中的溶液,滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+,说明黑色沉淀是铜的硫化物;CuS+4H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+4SO2↑+4H2O;
(4)设消耗高锰酸钾xmol,
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
1mol 5mol
xmol 0.350L×0.1mol/L
所以x=0.007,
高锰酸钾的总物质的量为0.400L×0.075mol/L=0.03mol,
所以KMnO4溶液与混合物反应,消耗KMnO4的物质的量为0.03mol-0.007mol=0.023mol,
设Cu2S的物质的量为mmol,CuS的物质的量为nmol,
8MnO4-+44H++5Cu2S=10Cu2++5SO2+8Mn2++22H2O
8 5
$\frac{8m}{5}$mol mmol
6MnO4-+28H++5CuS=5Cu2++5SO2+6Mn2++14H2O
6 5
$\frac{6}{5}n$ nmol
所以列方程组为:$\left\{\begin{array}{l}{160mg}&{+96ng=2g}\\{\frac{8m}{5}mol+}&{\frac{6n}{5}mol=0.023mol}\end{array}\right.$
解得:$\left\{\begin{array}{l}{m=o.oo5}\\{n=0.0125}\end{array}\right.$
所以Cu2S的质量为0.8g,CuS的质量为1.2g,
Cu2S的质量分数为$\frac{0.8g}{2g}$×100%=40%,
故答案为:40%.
点评 本题考查了浓硫酸的化学性质、性质实验方案的设计与化学计算,题目难度较大,知识点较多,理解题中信息和反应原理是解题关键,如根据铜离子检验方法解答(2)③,试题培养了学生的分析、理解能力.

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案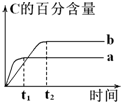 已知反应A(g)+B(g)?nC(g)△H=x kJ•mol-1,在不同条件下进行时,混合物中C的百分含量随时间变化的关系如右图.下列有关叙述一定正确的是( )
已知反应A(g)+B(g)?nC(g)△H=x kJ•mol-1,在不同条件下进行时,混合物中C的百分含量随时间变化的关系如右图.下列有关叙述一定正确的是( )| A. | a条件下的反应速率小于b条件下的反应速率 | |
| B. | 其他条件相同时,a表示有催化剂,b表示无催化剂 | |
| C. | 其他条件相同,若a、b表示不同压强下的反应,则n>2 | |
| D. | 其他条件相同,若a、b表示不同温度下的反应,则x>0 |
| A. | 可以用澄清的石灰水鉴别SO2和CO2 | |
| B. | SO2能使溴水、KMnO4溶液迅速褪色 | |
| C. | 硫粉在过量的氧气中燃烧可得到SO3 | |
| D. | 少量SO2通入到浓的CaCl2溶液能生成白色沉淀 |
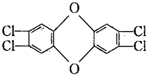 :下列有关该化合物的说法中正确的是( )
:下列有关该化合物的说法中正确的是( )| A. | 分子式为C12H8O2Cl4 | B. | 是一种可溶于水的气体 | ||
| C. | 是最危险的致癌物之一 | D. | 是一种多卤代烃 |
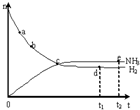 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反N2(g)+3H2(g)?2NH3(g),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反N2(g)+3H2(g)?2NH3(g),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a时正反应速率比逆反应速率小 | |
| B. | 点d:v正(H2)=3v逆(N2) | |
| C. | 点d(t1时刻)和点e(t2时刻)处n(N2)不一样 | |
| D. | 点c处反应达到平衡 |
| A. | 乙醇、乙二醇、丙三醇互为同系物,同系物之间不可能为同分异物体 | |
| B. | 北京奥运会奖牌--“金镶玉”奖牌玉的化学成分多为含水钙镁硅酸盐,如:Ca2Mg5Si8O22(OH)2可用氧化物表示为:2CaO•5MgO•8SiO2•H2O | |
| C. | 次氯酸的结构式为:H-Cl-O | |
| D. | 丙烷分子的比例模型示意图: |
| A. | 1 mol | B. | 2 mol | C. | 3 mol | D. | 1000 mol |
 X、Y、Z、W、R是原子序数依次增大的前四周期元素.X的单质在Y2中燃烧可生成XY和XY2两种气体;Z的单质在Y2中燃烧的产物ZY2可使品红溶液褪色;W的单质是黄绿色的有毒气体;R3+离子的3d轨道半充满.请回答下列问题:
X、Y、Z、W、R是原子序数依次增大的前四周期元素.X的单质在Y2中燃烧可生成XY和XY2两种气体;Z的单质在Y2中燃烧的产物ZY2可使品红溶液褪色;W的单质是黄绿色的有毒气体;R3+离子的3d轨道半充满.请回答下列问题: