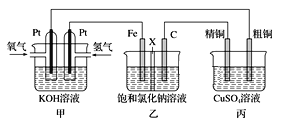
题目内容
【题目】已知298K时下列物质的溶度积
CH3COOAg | AgCl | AgCrO4 | AgS | |
Ksp | 2.3×10-3 | 1.77×10-10 | 1.12×10-12 | 6.7×10-15 |
下列说法正确的是( )
A.等体积浓度均为0.02molL-1的CH3COONa和AgNO3溶液混合能产生沉淀
B.浓度均为0.01molL-1的CrO42-和Cl-混合溶液中慢慢滴入AgNO3溶液时,CrO42-先沉淀
C.在CH3COOAg悬浊液中加入盐酸发生反应的离子方程式:CH3COOAg+H++C1-=CH3COOH+AgCl
D.298K时,上述四种饱和溶液的物质的量浓度:c(CH3COOAg)>c(AgCl)>c(Ag2CrO4)>c(Ag2S)
【答案】C
【解析】
A、浓度熵QC=c(CH3COO-)c(Ag+)=0.01×0.01=1×10-4,KSP(CH3COOAg)=2.3×10-3,QC<KSP,所以溶液混合不能产生沉淀,故A错误;
B、AgCl饱和所需Ag+浓度c(Ag+)=![]() =
=![]() mol/L=1.77×10-8 mol/L;Ag2CrO4饱和所需Ag+浓度c(Ag+)=
mol/L=1.77×10-8 mol/L;Ag2CrO4饱和所需Ag+浓度c(Ag+)=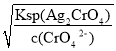 =
=![]() mol/L=1.1×10-5 mol/L,则1.77×10-8 mol/L<1.1×10-5 mol/L),所以Cl-先沉淀,故B错误;
mol/L=1.1×10-5 mol/L,则1.77×10-8 mol/L<1.1×10-5 mol/L),所以Cl-先沉淀,故B错误;
C、CH3COOAg沉淀的溶度积大于AgCl沉淀的溶度积,所以CH3COOAg+H++C1-=CH3COOH+AgCl,故C正确;
D、因为CH3COOAg饱和溶液中Ag+的浓度为![]() molL-1=0.48×10-2molL-1,所以c(CH3COOAg)=0.48×10-2molL-1;因为AgCl饱和溶液中Ag+的浓度为
molL-1=0.48×10-2molL-1,所以c(CH3COOAg)=0.48×10-2molL-1;因为AgCl饱和溶液中Ag+的浓度为![]() =1.33×10-5molL-1,所以c(AgCl)=1.33×10-5molL-1;假设Ag2CrO4饱和溶液中Ag+的浓度为x,则CrO42-的浓度为0.5x,由溶度积常数的表达式可知Ksp(Ag2CrO4)=x2×0.5x=0.5x3=1.12×10-12,x3=2.24×10-12,即x=
=1.33×10-5molL-1,所以c(AgCl)=1.33×10-5molL-1;假设Ag2CrO4饱和溶液中Ag+的浓度为x,则CrO42-的浓度为0.5x,由溶度积常数的表达式可知Ksp(Ag2CrO4)=x2×0.5x=0.5x3=1.12×10-12,x3=2.24×10-12,即x=![]() =1.3×10-4molL-1,所以c(Ag2CrO4)=0.65×10-4molL-1;假设Ag2S饱和溶液中Ag+的浓度为x,则S2-的浓度为0.5x,由溶度积常数的表达式可知Ksp(Ag2S)=x2×0.5x=0.5x3=6.7×10-15,x3=13.4×10-15,即x=2.38×10-5molL-1,所以c(Ag2S)=1.19×10-5molL-1。则顺序为:c(CH3COOAg)>c(Ag2CrO4)>c(AgCI)>c(Ag2S),故D错误;故选C。
=1.3×10-4molL-1,所以c(Ag2CrO4)=0.65×10-4molL-1;假设Ag2S饱和溶液中Ag+的浓度为x,则S2-的浓度为0.5x,由溶度积常数的表达式可知Ksp(Ag2S)=x2×0.5x=0.5x3=6.7×10-15,x3=13.4×10-15,即x=2.38×10-5molL-1,所以c(Ag2S)=1.19×10-5molL-1。则顺序为:c(CH3COOAg)>c(Ag2CrO4)>c(AgCI)>c(Ag2S),故D错误;故选C。

【题目】某 500 mL 溶液中只可能含有 Na+、NH4+、Mg2+、Al3+、Fe2+、Fe3+、Cl-、![]() 、
、![]() 中 的几种离子。
中 的几种离子。
已知:NH4++OH-=NH3↑ +H2O
(1)取该溶液l00 mL,逐滴加入足量的NaOH溶液并加热,生成标准状况下的气体体积为 896 mL(气体已全部逸出),滴加过程中无沉淀生成。则该溶液中一定不含有的阳离子是______.
(2)另取100 mL原溶液于试管中,滴加足量的BaCl2溶液,生成白色沉淀6.27 g,再加入足量稀盐酸,沉淀部分溶解,生成标准状况下的气体体积为448 mL。则原浓液中下列离子的浓度:
离子种类 | 离子浓度 |
| ①___molL-1 |
| ②___ molL-1 |
Na+ | ③__molL-1 |
写出加入盐酸时,生成气体的离子方程式:__________。