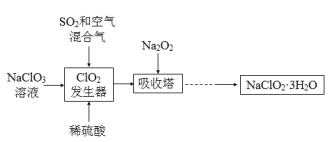
题目内容
【题目】生产硫酸的主要反应:2SO2(g)+O2(g)![]() 2SO3(g)△H<0。图中L(L1、L2)、X可分别代表压强或温度。下列说法正确的是
2SO3(g)△H<0。图中L(L1、L2)、X可分别代表压强或温度。下列说法正确的是
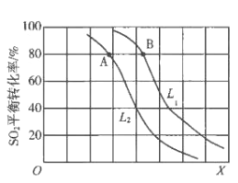
A. X代表压强
B. 推断L1>L2
C. A、B两点对应的平衡常数相同
D. 一定温度下,当混合气中n(SO2):n(O2):n(SO3)=2:1:2,则反应一定达到平衡
【答案】B
【解析】
生产硫酸的主要反应:2SO2(g)+O2(g)![]() 2SO3(g)△H<0,该反应的正反应是一个气体分子数目减少的放热反应,根据化学平衡移动原理可知,在其它条件不变时,随温度的升高,化学平衡逆向移动,二氧化硫的平衡转化率下降,故X代表温度;随着压强的增大,二氧化硫的平衡转化率增大,故图中L代表压强,且L1>L2,据此分析可得结论。
2SO3(g)△H<0,该反应的正反应是一个气体分子数目减少的放热反应,根据化学平衡移动原理可知,在其它条件不变时,随温度的升高,化学平衡逆向移动,二氧化硫的平衡转化率下降,故X代表温度;随着压强的增大,二氧化硫的平衡转化率增大,故图中L代表压强,且L1>L2,据此分析可得结论。
A.因该反应正反应是一个分子数目减少的反应,增大压强,平衡正向移动,二氧化硫的平衡转化率应增大,与图示变化不符,故A错误;
B.由上述分析可知,图中L代表压强,因该反应正反应是一个分子数目减少的反应,所以在其它条件相同时,压强越大,二氧化硫的转化率越大,则L1>L2,故B正确;
C.由上述分析可知,X代表温度,则A、B两点的温度不同,化学平衡常数不同,故C错误;
D.一定温度下,当混合气中n(SO2):n(O2):n(SO3)=2:1:2时,反应混合物中各组份的浓度不一定保持不变,不一定是平衡状态,故D错误;
答案选B。

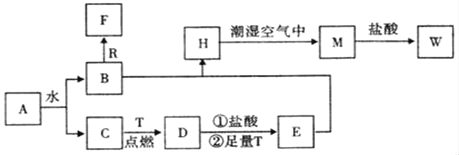
【题目】下表是元素周期表的一部分, 针对表中的①~⑧种元素,填写下列空白:
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA[ | 零 |
2 | ① | ② | ③ | |||||
3 | ④[ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)上述元素中,化学性质最不活泼的是 (填元素符号)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是 (填元素符号)。
(3)元素②的气态氢化物分子属于 (填电解质或非电解质);元素⑦与④形成化合物的电子式是 。
(4)元素⑤的最高价氧化物与氢氧化钠溶液反应的离子方程式为: 。
(5)元素④的某氧化物可作供氧剂,该氧化物中所含的化学键类型有 ,写出其与二氧化碳反应的化学方程式 。
【题目】将甘油(C3H8O3)转化成高附加值产品是当前热点研究方向,如甘油和水蒸气、氧气经催化重整或部分催化氧化可制得氢气,反应主要过程如下:
甘油水蒸气重整 (SPG) | C3H8O3(1)+3H2O(g) | 反应I |
甘油部分氧化 (POG) | C3H8O3(1)+ | 反应II |
甘油氧化水蒸气 重整(OSRG) | C3H8O3(1)+ | 反应III |
(1)下列说法正确的是________(填字母序号)。
a. 消耗等量的甘油,反应I的产氢率最高
b. 消耗等量的甘油,反应Ⅱ的放热最显著
c. 经过计算得到反应Ⅲ的 △H3=-237.5 kJ·mol-1
d. 理论上,通过调控甘油、水蒸气、氧气的用量比例可以实现自热重整反应,即焓变约为0,这体现了科研工作者对吸热反应和放热反应的联合应用
(2)研究人员经过反复试验,实际生产中将反应Ⅲ设定在较高温度(600~700℃)进行,选择该温度范围的原因有:催化剂活性和选择性高、__________。
(3)研究人员发现,反应I的副产物很多,主要含有:CH4、C2H4、CO、CO2、CH3CHO,CH3COOH等,为了显著提高氢气的产率,采取以下两个措施。
①首要抑制产生甲烷的副反应。从原子利用率角度分析其原因:___________。
②用CaO吸附增强制氢。如图1所示,请解释加入CaO的原因:__________。

(4)制备高效的催化剂是这种制氢方法能大规模应用于工业的重要因素。通常将Ni分散在高比表面的载体(SiC、Al2O3、CeO2)上以提高催化效率。分别用三种催化剂进行实验,持续通入原料气,在一段时间内多次取样,绘制甘油转化率与时间的关系如图2所示。
①结合图2分析Ni/SiC催化剂具有的优点是_________。
②研究发现造成催化效率随时间下降的主要原因是副反应产生的大量碳粉(积碳)包裹催化剂,通过加入微量的、可循环利用的氧化镧(La2O3)可有效减少积碳。其反应机理包括两步:
第一步为:La2O3+CO2![]() La2O/span>2CO3
La2O/span>2CO3
第二步为:__________(写出化学反应方程式)。