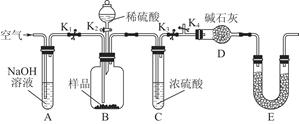
题目内容
铁及其化合物在国民经济的发展中起着重要作用。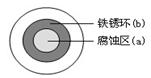
(1)已知:4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1641.0kJ·mol-1 C(石墨)+1/2O2(g)=CO(g) △H=-110.5 kJ·mol-1则Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)的△H= kJ·mol-1。
(2)铁在潮湿的空气中易发生电化学腐蚀。某同学将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。液滴边缘是 区(填“正极”或“负极”),其电极反应式为 。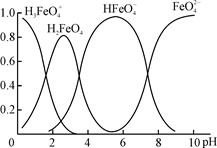
(3)铁钛合金是一种常用的不锈钢材料,某同学在探究该合金的性质时,往含有TiO2+、Fe3+溶液中加入铁屑至溶液显紫色,该过程中发生的反应有:
①2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
②Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
③ 。
(4)①高铁酸钾(K2FeO4)是一种优良的水处理剂。FeO在水溶液中的存在形态如右图所示,纵坐标表示各存在形态的分数分布。
下列说法不正确的是 。(填字母)
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO+OH-=FeO+H2O
②K2FeO4溶于水会放出一种无色无味气体,其杀菌消毒、吸附水中的悬浮杂质的原理可用离子方程式表示为 。
(5)向一定量的Fe、FeO、Fe3O4的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,放出224 mL(标准状况)气体,加入KSCN溶液不显红色。若用足量的CO在高温下还原相同质量的此混合物,可得铁 g。
(1)+489.0
(2)正极 O2+2H2O+4e-=4OH-
(3)2Fe3++Fe=3 Fe2+
(4)①AB ②4FeO+10H2O=4Fe(OH)3+8OH-+3O2↑
(5)2.8 g
解析试题分析: (1)由盖斯定律得,△H="-110.5" kJ·mol-1×3-[(-1642 kJ·mol-1)÷2]= +489.0kJ·mol-1。(2)铁发生吸氧腐蚀,液滴边缘电极反应式为O2+2H2O+4e-=4OH-,液滴边缘为正极区。(3)加入的Fe与Fe3+生成Fe2+。(4)pH为2时,铁元素有三种存在形态,pH为4、6、8时,铁元素有两种存在形态,A错误;向pH=10的这种溶液中加硫酸至pH=2,HFeO的分布分数先增大后减小,B错误;pH=6的这种溶液中加KOH溶液,FeO分布分数增大,HFeO分布分数减小,离子方程式为HFeO+OH-=FeO+H2O,C正确。(5)混合物中加盐酸后,再加KSCN溶液不显红色说明溶液中溶质为FeCl2,Fe与Cl物质的量比为1:2,Cl来自盐酸,物质的量为0.1mol,所以Fe元素物质的量为0.05mol,用CO还原同质量的混合物得到铁物质的量亦为0.05mol,质量为2.8g。
考点: 盖斯定律 原电池 离子方程式 图像的分析 化学计算

(14分)铁、铝、铜、硅及其合金材料在生产生活中有着广泛的应用。请回答下列有关问题。
(1)目前已冶炼出纯度达99.9999%的铁。下列关于纯铁的叙述错误的是
(填字母)。
| A.硬度比钢小,熔点比钢高 | B.不能与盐酸反应 |
| C.与不锈钢成分相同 | D.在冷的浓硫酸中钝化 |
(2)铝热反应可用于焊接钢轨、冶炼熔点较高的金属。请写出用V2O5冶炼钒的化学方程式:
(3)①铜在干燥的空气中性质稳定,在潮湿的空气里会被锈蚀形成一层绿色的铜锈,反应的化学方程式是
②工业上常以黄铜矿为原料,采用火法溶炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S
 6Cu+SO2↑,该反应的氧化剂是
6Cu+SO2↑,该反应的氧化剂是 ③将铜粉放入稀硫酸中加热并不断鼓入空气,铜溶解,产物只有硫酸铜与水 。
该反应的化学方程式: ,
此法比直接用浓硫酸与铜反应有两个明显的优点:
。
(4)制备高纯硅的流程如下图:

写出石英砂制备粗硅的化学方程式:
。
总的物质的量为0.50 mol的Fe粉与Al粉混合物分为等质量的两份;在一份中加入足量
的稀盐酸,在标准状况下产生气体a L;在另一份中加入足量的氢氧化钠溶液,在标准状况下产生气体b L。则a+b的数值不可能是
| A.5.6 | B.7.3 | C.8.2 | D.11.2 |
某研究性学习小组在网上收集到信息:钠、镁等活泼金属都能在CO2气体中燃烧。他们对钠在CO2气体中燃烧后得到的白色产物进行了如下探究:
【实验操作】将燃烧的钠迅速伸入装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底有黑色颗粒,瓶壁上附着白色物质。
【提出假设】
假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物。
【设计方案】该小组对燃烧后生成的白色物质进行如下探究:
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液。②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | ①出现白色沉淀 ②无明显现象 | 白色物质为Na2CO3 |
回答下列问题:
(1)写出金属镁与二氧化碳反应的化学方程式: 。
(2)甲同学认为方案1得到的结论不正确,其理由是 。
(3)乙同学认为方案2得到的结论正确,白色物质为 。
(4)钠在二氧化碳中燃烧的化学反应方程式为 。
(5)丙同学认为白色物质有可能是氢氧化钠。你是否同意丙同学的观点,并简述理由: 。
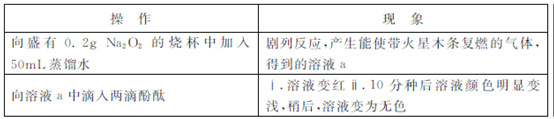
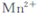 )可以测定H2O2的含量?
)可以测定H2O2的含量?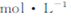 KMnO4溶液,产生气体,溶液褪色速率开始较慢后变快,至终点时共消耗10mL KMnO4溶液?
KMnO4溶液,产生气体,溶液褪色速率开始较慢后变快,至终点时共消耗10mL KMnO4溶液? ?
?