题目内容
7. 为解决能源短缺问题,工业生产中应合理利用化学能.
为解决能源短缺问题,工业生产中应合理利用化学能.(1)25℃,1.01×105 Pa时,实验测得,4g氢气在O2中完全燃烧生成液态水,放出572kJ的热量,则表示H2的燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286kJ/mol.
(2)如图是某笔记本电脑使用的甲醇燃料电池的结构示意图.放电时甲醇应从a处通入(填“a”或“b”),电池内部H+向右(填“左”或“右”)移动.写出电池负极的电极反应式2CH3OH+2H2O-12e-═2CO2+12H+.正极的电极反应式3O2+12e-+12H+═6H2O.
(3)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.
已知:N2(g)+3H2(g)═2NH3(g)△H=-93kJ•mol-1.
试根据表中所列键能数据计算a的数值391.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | a | 945 |
(4)已知:C(s,石墨)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1①
2H2(g)+O2(g)═2H2O(l)△H2=-571.6kJ•mol-1②
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1③
根据盖斯定律,计算反应2C(s,石墨)+H2(g)═C2H2(g)的△H=+226.7kJ•mol-1.
分析 (1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;根据n=$\frac{m}{M}$计算1mol氢气完全燃烧放出的热量,结合热化学方程式的书写方法写出热化学方程式;
(2)根据电子流向可知a为负极,负极发生氧化反应,b为正极发生还原反应,溶液中阳离子移向正极;
(3)根据反应热等于反应物的总键能-生成物的总键能求算;根据热化学方程式计算当可逆反应中净生成N-H物质的量为2mol 时,反应放出的热量;
(4)①C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
③2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2599kJ•mol-1
利用盖斯定律将①×2+②×$\frac{1}{2}$-③×$\frac{1}{2}$计算反应热.
解答 解:(1)4g氢气即2mol在O2中完全燃烧生成液态水,放出572kJ的热量,则1mol氢气在氧气中燃烧生成液态水,放出286kJ的热量,则表示H2的燃烧热的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286 kJ/mol,
故答案为:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286 kJ/mol;
(2)原电池中电子从负极经外电路流向正极,根据电子流向可知a电极为负极,甲醇在负极上发生氧化反应,电极反应式为2CH3OH+2H2O-12e-═2CO2+12H+,b为正极,氧气得电子发生还原反应,电极反应式为3O2+12e-+12H+═6H2O,氢离子移向正极右侧,
故答案为:a;右;2CH3OH+2H2O-12e-═2CO2+12H+;3O2+12e-+12H+═6H2O;
(3)N2(g)+3H2(g)???2NH3(g)△H=945kJ•mol-1+436kJ•mol-1×3-akJ•mol-1×6=-93kJ•mol-1,a=391 kJ•mol-1,当可逆反应中净生成N-H物质的量为2mol 时,即生成$\frac{2}{3}$molNH3,所以反应放热为$\frac{2}{3}$×$\frac{1}{2}$×93=31KJ,故答案为:391;31KJ;
(4)①C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
③2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2599kJ•mol-1
利用盖斯定律将①×2+②×$\frac{1}{2}$-③×$\frac{1}{2}$可得:
2C(s,石墨)+H2(g)=C2H2(g)△H=(-393.5kJ/mol)×2+$\frac{1}{2}$×(-571.6kJ/mol)-$\frac{1}{2}$×(-2599 kJ/mol)=+226.7kJ•mol-1,
故答案为:+226.7kJ•mol-1.
点评 本题考查了热化学方程式的书写、原电池原理以及电极反应式的书写、据键能计算焓变、盖斯定律的应用,题目难度不大.

| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
| A. | 丙烯(CH3CH=CH2)在一定条件下加聚后可得聚丙烯: | |
| B. | 某塑料 可由CF2=CF2和CF2=CFCF3通过加聚反应制得 可由CF2=CF2和CF2=CFCF3通过加聚反应制得 | |
| C. | 合成高分子  的单体是CF2=CF2 的单体是CF2=CF2 | |
| D. | 一种全降解塑料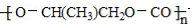 可由 可由  和 CO2在催化剂作用下加聚生成 和 CO2在催化剂作用下加聚生成 |
| A. | 甲烷和乙醇 | B. | 丙烯和丙烷 | C. | 乙酸和乙酸乙酯 | D. | 苯和乙烯 |
| A. | NO2的消耗速率与NO的生成速率相等 | |
| B. | 容器内气体的密度不随时间变化而变化 | |
| C. | NO2和O2的消耗速率之比为2:1 | |
| D. | 混合气体的质量不再变化 |
| A. | v(A)=v(C)=0.75 mol•L-1•s-1 | B. | z=3 | ||
| C. | B的转化率为25% | D. | C的体积分数为28.6% |
 甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间的转化关系如图所示(反应条件己略去).下列有关物质的推断正确的是( )
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间的转化关系如图所示(反应条件己略去).下列有关物质的推断正确的是( )| 甲 | 乙 | 丙 | 丁 | |
| A | N2 | NO | NO2 | O2 |
| B | CO32- | HCO3- | CO2 | H+ |
| C | Cl2 | FeCl3 | FeCl2 | Fe |
| D | Al3+ | Al(OH)3 | AlO2- | NH3•H2O |
| A. | A | B. | B | C. | C | D. | D |
| A. | Br-CH2CH2OH | B. |  | C. |  | D. | HOCH2CH2OH |
| 选项 | 实验事实 | 理论解释 |
| A | HCl气体溶于水,能电离出H+、Cl- | HCl为离子化合物 |
| B | HBr的酸性强于HCl的酸性 | Br的非金属性比Cl强 |
| C | HF的沸点高于HCl | F的非金属性比Cl强 |
| D | K3C60在熔融状态下能够导电 | K3C60中含有离子键 |
| A. | A | B. | B | C. | C | D. | D |