题目内容
常温下,下列各组离子在指定溶液中能大量共存的是
| A.pH=1的溶液中:K+、Fe2+、MnO4-、SO42- |
| B.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN- |
| C.c(H+)/c (OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- |
| D.与铝反应生成氢气的溶液中:NH4+、K+、Cl-、SiO32- |
C
解析试题分析:A、pH=1的溶液显酸性,MnO4?氧化Fe2+,不能大量共存;B、Fe3+能与SCN?发生络合反应,不能大量共存;C、c(H+)/c (OH-)=1012的溶液显酸性,各离子互不反应,可以大量共存;D、与铝反应生成氢气的溶液可能为酸性,也可能为碱性,但酸性时,H+与SiO32?反应,碱性时,OH?与NH4+反应,不能大量共存。
考点:本题考查离子共存。

练习册系列答案
相关题目
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A.无色溶液中:K+、Na+、Cu2+、SO42- |
| B.c(H+)/c(OH-)=1×10-14的溶液:K+、Na+、Cl-、SiO32- |
| C.由水电离出的C(OH-)=1×10-12 mol·L-1的溶液:NH4+、HCO3-、Na+、Cl- |
| D.c(OH-)=10-13 mol·L-1的溶液中:Al3+、NO3-、I-、Cl- |
已知Ba(AlO2)2可溶于水。右图表示的是向A12(SO4) 3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加人Ba(OH)2的物质的量x的关系。下列有关叙述正确的是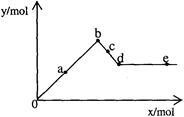
| A.a—b时沉淀的物质的量:A1(OH)3比BaSO4多 |
| B.c—d时溶液中离子的物质的量:AlO2-比Ba2+多 |
| C.a—d时沉淀的物质的量:BaSO4可能小于A1(OH)3 |
| D.d—e时溶液中离子的物质的量:Ba2+不可能等于OH- |
某地甲、乙两厂排放的污水中各含有下列8种离子中的4种(两厂废水所含离子不同):Ag+、Ba2+、Fe2+、Na+、Cl-、SO42-、NO3-、OH-。若两厂单独排放污水都会造成严重的水污染,如将两厂的污水按一定比例混合,沉淀后污水便能变得无色澄清,溶质主要含硝酸钠,污染程度大大降低。根据所给信息有以下几种说法,你认为正确的是
| A.Na+和NO3-来自同一工厂 | B.Cl-和NO3-一定来自同一工厂 |
| C.Ag+和Na+可能来自同一工厂 | D.SO42-和OH-一定来自同一工厂 |
下列方程式书写正确的是( )
| A.醋酸和氨水恰好完全中和:CH3COOH+NH3·H2O=CH3COO﹣+NH4++H2O |
| B.氢溴酸溶于水中:HBr≒H++Br﹣ |
| C.Na2CO3溶液中:CO32﹣+2H2O≒H2CO3+2OH﹣ |
| D.在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l):△H=﹣285.8kJ/mol |
在室温下,下列各组微粒在溶液中能大量共存的是( )
| A.Na+、Ba2+、OH-、Cl- | B.H+、Fe2+、ClO-、SO42- |
| C.K+、Fe3+、C6H5O-、SCN- | D.NH4+、Al3+、SiO32-、CO32- |
在碱性溶液中能够大量共存且溶液为无色透明的离子组是
| A.Na+ NH4+ NO3- Cl- | B.Na+ K+ CO32- NO3- |
| C.K+ Ba2+ HCO3- Cl- | D.Na+ K+ MnO4- SO42- |
在水溶液里或熔融状态下能导电的化合物是电解质。下列物质不属于电解质的是
| A.Fe | B.NaOH | C.H2SO4 | D.Na2SO4 |
下列叙述正确的是
| A.固体氯化钠不导电,所以氯化钠不是电解质 |
| B.铜丝能导电,所以铜是电解质 |
| C.氯化氢水溶液能导电,所以氯化氢是电解质 |
| D.SO3 溶于水能导电,所以 SO3 是电解质 |