题目内容
下列叙述正确的是
| A.固体氯化钠不导电,所以氯化钠不是电解质 |
| B.铜丝能导电,所以铜是电解质 |
| C.氯化氢水溶液能导电,所以氯化氢是电解质 |
| D.SO3 溶于水能导电,所以 SO3 是电解质 |
C
解析试题分析:A. 氯化钠是电解质,固体氯化钠中含有离子,但由于不能自由移动,因此不能导电。错误。B.铜丝能导电是因为含有自由移动的电子。但铜是单质,不是化合物,所以不是电解质。错误。C.氯化氢在水中能电离产生自由移动的离子,水溶液能导电,所以氯化氢是电解质。正确。D.SO3 溶于水能导电,是因为发生反应:SO3+ H2O= H2SO4,H2SO4电离产生了自由移动的H+和SO42-。所以应该说H2SO4电解质。SO3 没有产生自由移动的离子。故是非电解质。错误。
考点:考查电解质、非电解质的判断及电解质导电与金属导电的区别的知识。

练习册系列答案
相关题目
常温下,下列各组离子在指定溶液中能大量共存的是
| A.pH=1的溶液中:K+、Fe2+、MnO4-、SO42- |
| B.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN- |
| C.c(H+)/c (OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- |
| D.与铝反应生成氢气的溶液中:NH4+、K+、Cl-、SiO32- |
下列说法正确的是( )
| A.KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 |
| B.向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 |
| C.25℃时、用醋酸溶液滴定等浓度NaOH溶液至pH=7,V(醋酸)> V(NaOH) |
| D.AgCl易转化为AgI沉淀且KSP(AgX)=c(Ag+)? c(X?),故KSP(AgI) > KSP(AgCl) |
常温下,下列各组离子在指定溶液中一定能大量共存的是 ( )
| A.无色透明的溶液:Na+、Al3+、Cl-、OH- |
| B.pH=1的溶液:Na+、NH4+、Cu2+、NO3- |
| C.与铝反应产生大量氢气的溶液:Na+、K+、Cl-、Al3+ |
| D.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- |
下列离子在溶液中能大量共存的是
| A.Na+、K+、HCO3-、H+ | B.Fe2+、Fe3+、Na+、NO3- |
| C.OH-、Na+、HCO3-、SO42- | D.Ba2+、NH4+、Cl- 、OH- |
下列表示对应化学反应的离子方程式正确的是( )
A.NH4HCO3溶液与过量KOH浓溶液共热:NH4+ + OH-  NH3↑+ H2O NH3↑+ H2O |
| B.向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性: Ba2++ OH- + H+ + SO42- = BaSO4↓+ H2O |
| C.将少量醋酸溶液滴加到Na2CO3溶液中的反应:CH3COOH+CO32-= CH3COO-+HCO3- |
| D.向NaAlO2溶液中通入过量CO2:2AlO2-+ CO2 + 3H2O = 2Al(OH)3↓+ CO32- |
下列离子方程式的书写正确的是( )
| A.实验室用大理石和稀盐酸制取CO2:2H+ + CO32-= CO2 + H2O |
| B.铁和稀硫酸反应:Fe + 2H+= H2 + Fe3+ |
| C.NH4HCO3溶液中加入过量的NaOH溶液:NH4+ + OH-= NH3+H2O |
| D.NaHCO3溶液与NaOH溶液反应:OH- + HCO3-= CO32- + H2O |
在含有4 mol HCl和1 mol MgSO4的混合溶液中逐滴加入Ba(OH)2溶液,产生的沉淀质量m与加入Ba(OH)2物质的量n之间的关系如右图,下列说法正确的是( )
| A.a→b时的沉淀的成分为BaSO4与Mg(OH)2 |
| B.b→c时发生的离子反应为:H+ + OH— → H2O |
| C.c→d时离子的物质的量:Ba2+可能大于Cl— |
| D.d→e时离子的物质的量:Ba2+一定大于OH— |
下列反应的离子方程式书写正确的是
A.FeS固体溶于稀HNO3: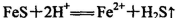 |
B.AlCl3和过量氨水反应: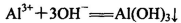 |
C.向AgCI悬浊液中滴加硫化钠溶液,白色沉淀变成黑色: |
D.等体积等浓度的NaHSO4与Ba(OH)2溶液混合: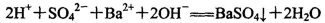 |