题目内容
10.已知一个N2O3分子的质量为a g,一个N2O5分子的质量为b g,若以一个氧原子质量的$\frac{1}{6}$作为相对原子质量的标准,则NO2的相对分子质量为( )| A. | $\frac{3(a+b)}{b-a}$ | B. | $\frac{16(b+a)}{b-a}$ | C. | $\frac{8(b-a)}{b+a}$ | D. | $\frac{16(b-a)}{b+a}$ |
分析 1个N2O5分子比1个N2O3多两个氧原子,所以其质量差恰好为2个氧原子的质量,也就是(b-a)g,则一个氧原子的质量是$\frac{b-a}{2}$g,以一个氧原子质量的$\frac{1}{6}$作为相对原子质量的标准,即标准为$\frac{b-a}{2}$g×$\frac{1}{6}$=$\frac{b-a}{12}$g,又因1个NO2分子的质量恰好就是一个N2O3分子和一个N2O5分子的质量之和的$\frac{1}{4}$,结合相对分子质量为分子质量与标准的比值来解答.
解答 解:1个N2O5分子比1个N2O3多两个氧原子,所以其质量差恰好为2个氧原子的质量,也就是(b-a)g,则一个氧原子的质量是$\frac{b-a}{2}$g,以一个氧原子质量的$\frac{1}{6}$作为相对原子质量的标准,即标准为$\frac{b-a}{2}$g×$\frac{1}{6}$=$\frac{b-a}{12}$g,又因1个NO2分子的质量恰好就是一个N2O3分子和一个N2O5分子的质量之和的$\frac{1}{4}$,则NO2的相对分子质量为$\frac{(a+b)×\frac{1}{4}}{(b-a)×\frac{1}{12}}$=$\frac{3(a+b)}{b-a}$,故选A.
点评 本题考查物质的量的计算,为高频考点,把握物质构成、质量关系及相对分子质量的计算方法为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
20.反应2R(g)+5Q(g)═4X(g)+2Y(g)在2L的密闭容器中进行,20s后,R减少了0.04mol,则平均每分钟浓度变化正确的是( )
| A. | R:0.08mol•L-1 | B. | Q:0.05mol•L-1 | C. | X:0.12mol•L-1 | D. | Y:0.06mol•L-1 |
1.下列说法中正确的是( )
| A. | 胶体区别于其它分散系的本质特性是丁达尔现象 | |
| B. | 利用半透膜可除去淀粉溶液中的少量NaCl | |
| C. | Fe(OH)3胶体带正电荷 | |
| D. | 加入电解质,胶体一定能发生凝聚 |
18.下列说法正确的是( )
| A. | 石油是混合物,汽油是纯净物 | |
| B. | 分馏汽油和裂解汽油成分相同 | |
| C. | 沸点:汽油>煤油>柴油>润滑油 | |
| D. | 石油的分馏是物理过程,而裂化合裂解是化学过程 |
5.萘环上的碳原子的编号如(I)式,根据系统命名法,(II)式可称为2一硝基萘,则化合物 (III)的名称应是( )


| A. | 2,6一二甲基萘 | B. | 2,5一二甲基萘 | C. | 4,7一二甲基萘 | D. | 1,6一二甲基萘 |
15.在恒温下的密闭容器中,有可逆反应N2+3H2?2NH3(该反应放热),不能说明已达到平衡状态的是( )
| A. | 正反应生成的NH3速率和逆反应生成N2的速率相等 | |
| B. | 反应器中压强不随时间变化而变化 | |
| C. | 1molN≡N键断裂的同时,有6molN-H键断裂 | |
| D. | 混合气体平均分子量保持不变 |
2.化学是你,化学是我,化学深入我们生活.下列说法正确的是( )
| A. | 木材纤维和土豆淀粉遇碘水均显蓝色 | |
| B. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| C. | 食用花生油和鸡蛋清都能发生水解反应 | |
| D. | PX项目的主要产品对二甲苯属于饱和烃 |
4.将2molX 和2molY充入2L密闭容器中发生反应:X(g)+3Y(g)?2Z(g)+aQ(g).2min后达到平衡时生成0.8molZ,测得Q的浓度为0.6mol/L,下列叙述错误的是( )
| A. | a的值为3 | B. | 平衡时X的浓度为0.8mol/L | ||
| C. | Y的转化率为60% | D. | 反应速率v(Y)=0.2mol/(L•min) |
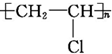 单体为CH2═CH-Cl.
单体为CH2═CH-Cl.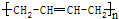 单体为CH2═CH-CH═CH2,
单体为CH2═CH-CH═CH2,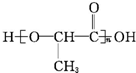 单体为
单体为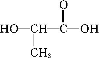 ,
,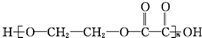 单体为HO-CH2CH2-OH和HOOC-COOH.
单体为HO-CH2CH2-OH和HOOC-COOH.