题目内容
20.反应2R(g)+5Q(g)═4X(g)+2Y(g)在2L的密闭容器中进行,20s后,R减少了0.04mol,则平均每分钟浓度变化正确的是( )| A. | R:0.08mol•L-1 | B. | Q:0.05mol•L-1 | C. | X:0.12mol•L-1 | D. | Y:0.06mol•L-1 |
分析 20s=$\frac{1}{3}$min,20s内v(R)=$\frac{\frac{0.04mol}{2L}}{\frac{1}{3}min}$=0.06mol/(L.min),则每分钟内△c(R)=0.06mol/L,同一化学反应中同一段时间内各物质浓度变化量之比等于其计量数之比,据此进行计算.
解答 解:20s=$\frac{1}{3}$min,20s内v(R)=$\frac{\frac{0.04mol}{2L}}{\frac{1}{3}min}$=0.06mol/(L.min),则每分钟内△c(R)=0.06mol/L,同一化学反应中同一段时间内各物质浓度变化量之比等于其计量数之比,所以每分钟内△c(Q)=$\frac{5}{2}$×0.06mol/L=0.15mol/L;
△c(X)=2△c(R)=2×0.06mol/L=0.12mol/L,△c(Y)=△c(Q)=0.06mol/L,
故选CD.
点评 本题考查化学反应速率有关计算,明确化学反应速率与浓度变化量、化学计量数关系是解本题关键,题目难度不大.

练习册系列答案
相关题目
11.如图所示的装置,C.D.E.F.X.Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )


| A. | 电源B极是正极 | |
| B. | 欲用丙装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 | |
| C. | 甲、乙装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:2 | |
| D. | 装置丁中Y极附近红褐色变深,说明氢氧化铁胶粒带负电荷 |
8.下列化学用语中,正确的是( )
| A. | 乙炔的结构简式CHCH | B. | 乙醇的比例模型 | ||
| C. | NaCl的电子式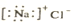 | D. | S原子结构示意图 |
15.下列物质的应用不正确的是( )
| A. | SO2可用于漂白纸浆 | B. | 碱石灰可用于干燥氯气 | ||
| C. | 氢氟酸可用于蚀刻玻璃 | D. | 碳酸氢钠可用于中和胃酸 |
5.有A、B两种有机物各取1mol在足量氧气中充分燃烧,分别生成7mol和3molCO2.只要A、B的总物质的量一定,不论A、B以任意物质的量之比混合,或只要A、B的总质量一定,不论A、B以任意质量之比混合,充分燃烧后生成水的量为一定值,已知A是苯的同系物,则B的分子式为( )
| A. | C3H6O | B. | C3H8O3 | C. | C3H8O2 | D. | C3H8O |
9.能用H++OH-═H2O表示的化学方程式有( )
| A. | 氢氧化钠溶液与硝酸反应 | B. | 氢氧化铁与硫酸反应 | ||
| C. | 氢氧化钡与硫酸反应 | D. | 硫酸氢钠与氢氧化钠溶液反应 |
10.已知一个N2O3分子的质量为a g,一个N2O5分子的质量为b g,若以一个氧原子质量的$\frac{1}{6}$作为相对原子质量的标准,则NO2的相对分子质量为( )
| A. | $\frac{3(a+b)}{b-a}$ | B. | $\frac{16(b+a)}{b-a}$ | C. | $\frac{8(b-a)}{b+a}$ | D. | $\frac{16(b-a)}{b+a}$ |

 氧化亚铜(Cu2O)作为一种重要的无机化工原料,在涂料、有色玻璃和催化剂灯领域有着广泛的用途.回答下列问题:
氧化亚铜(Cu2O)作为一种重要的无机化工原料,在涂料、有色玻璃和催化剂灯领域有着广泛的用途.回答下列问题: