题目内容
【题目】研究化学反应原理对于生产、生活及环境保护具有重要意义。请回答下列问题:
(1)常温下,物质的量浓度均为0.1 mol·L-1的四种溶液①NH4NO3 ②CH3COONa ③(NH4)2SO4 ④Na2CO3,pH从大到小排列顺序为_________________(填序号)。
(2)常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒物质的量变化如下图所示。
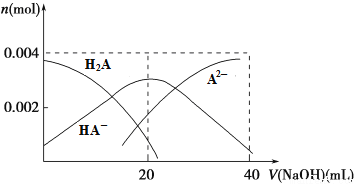
则当v(NaOH)=20 mL时,溶液中离子浓度大小关系:________,水的电离程度比纯水________(填“大”、“小”或“相等”)。
(3)含有Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol·L-1的Cr2O72-。为了使废水的排放达标,进行如下处理:
![]()
①该废水中加入绿矾(FeSO4·7H2O)和H+,发生反应的离子方程式为________________________。
②若处理后的废水中残留的c(Fe3+)=2.0×10-13mol·L-1,则残留的Cr3+的浓度为___________。(已知:Ksp[Fe(OH)3)]=4.0×10-38, Ksp[Cr(OH)3]=6.0×10-31)
(4)利用“Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“ Na-CO2”电池,以钠箔
和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2 ![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:

①放电时,正极的电极反应式为_____________________________。
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e- 时,两极的质量差为______g。
【答案】 ④>②>①>③ c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) 小 Cr2O72-+6Fe2+ +14H+=2Cr3++6Fe3++7H2O 3.0×10-6mol·L-1 3CO2+4Na++4e-===2Na2CO3+C 15.8
【解析】试题分析:(1)①NH4NO3、③(NH4)2SO4中铵根离子水解溶液呈酸性,(NH4)2SO4中铵根离子的浓度大于NH4NO3,所以(NH4)2SO4的酸性强;②CH3COONa、④Na2CO3都是强碱弱酸盐,溶液显碱性,碳酸根离子水解大于 醋酸根离子,所以碱性Na2CO3大于CH3COONa;(2)向20mL0.2mol/LH2A溶液中滴加20mL 0.2mol/LNaOH溶液,恰好生成NaHA,根据图示此时H2A小于A2-,说明HA-电离大于水解,所以溶液呈酸性;HA-电离出的氢离子抑制水电离;(3)①Cr2O72-与Fe2+发生氧化还原反应,生成Cr3+、Fe3+;②根据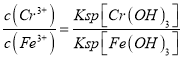 计算Cr3+的浓度;(4)4Na+3CO2
计算Cr3+的浓度;(4)4Na+3CO2![]() Na2CO3+C,碳元素化合价降低,所以是二氧化碳在正极发生还原反应生成碳;②根据图示,碳酸钠、碳都在正极生成。
Na2CO3+C,碳元素化合价降低,所以是二氧化碳在正极发生还原反应生成碳;②根据图示,碳酸钠、碳都在正极生成。
解析:(1)①NH4NO3、③(NH4)2SO4铵根离子水解溶液呈酸性,(NH4)2SO4中铵根离子的浓度大于NH4NO3,所以(NH4)2SO4的酸性强;②CH3COONa、④Na2CO3都是强碱弱酸盐,溶液显碱性,碳酸根离子水解大于 醋酸根离子,所以碱性Na2CO3大于CH3COONa,所以pH从大到小排列顺序为④>②>①>③;(2)向20mL0.2mol/LH2A溶液中滴加20mL 0.2mol/LNaOH溶液,恰好生成NaHA,此时H2A小于A2-,说明HA-电离大于水解,所以溶液呈酸性,所以溶液中离子浓度大小关系c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-);HA-电离出的氢离子抑制水电离水的电离程度比纯水小;(3)①Cr2O72-与Fe2+发生氧化还原反应,生成Cr3+、Fe3+,反应离子方程式是Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;②根据 ,c(Cr3+)=
,c(Cr3+)=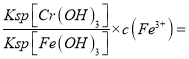 3.0×10-6mol/L;(4)4Na+3CO2
3.0×10-6mol/L;(4)4Na+3CO2![]() Na2CO3+C,碳元素化合价降低,所以是二氧化碳在正极发生还原反应生成碳,电极反应是3CO2+4Na++4e-=2Na2CO3+C;②根据3CO2+4Na++4e-=2Na2CO3+C,转移0.2mol电子,生成0.1mol Na2CO3和0.05mol C,质量是
Na2CO3+C,碳元素化合价降低,所以是二氧化碳在正极发生还原反应生成碳,电极反应是3CO2+4Na++4e-=2Na2CO3+C;②根据3CO2+4Na++4e-=2Na2CO3+C,转移0.2mol电子,生成0.1mol Na2CO3和0.05mol C,质量是![]() 11.2g,负极消耗钠0.2mol ,消耗钠4.6g,所以两极质量差是15.8g 。
11.2g,负极消耗钠0.2mol ,消耗钠4.6g,所以两极质量差是15.8g 。

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案【题目】X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下表所示:
元素代号 | X | Y | Z | M | Q | R |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.075 | 0.077 | 0.037 |
主要化合价 | +2 | +3 | +6,-2 | +5,-3 | +4,-4 | +1 |
(1)单质铜和元素M的最高价氧化物对应的水化物的稀溶液发生反应的离子方程式为________________________________________________________________________。
(2)元素Q、元素Z的含量影响钢铁性能,采用下图装置A在高温下将钢样中元素Q、元素Z转化为QO2、ZO2。
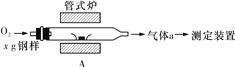
①气体a的成分是________________(填化学式)。
②若钢样中元素Z以FeZ的形式存在,在装置A中反应生成ZO2和稳定的黑色氧化物,则反应的化学方程式是:______________________________________________。
(3)用Z的最高价含氧酸W的溶液作电解质溶液(体积为1 L,假设反应前后溶液体积变化忽略不计)组装成原电池(如图所示)。则在a电极上发生的反应可表示为_________________。若电池工作一段时间后,a极消耗0.05 mol Pb,则W溶液的浓度由质量分数39%(密度为1.3 g/cm3)变为______mol/L(保留一位小数)。