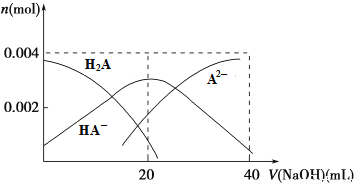
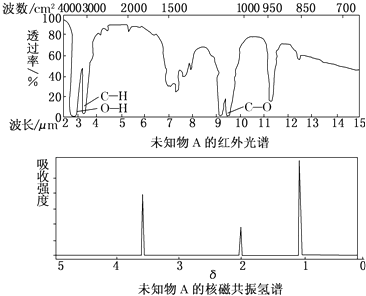
题目内容
【题目】X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下表所示:
元素代号 | X | Y | Z | M | Q | R |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.075 | 0.077 | 0.037 |
主要化合价 | +2 | +3 | +6,-2 | +5,-3 | +4,-4 | +1 |
(1)单质铜和元素M的最高价氧化物对应的水化物的稀溶液发生反应的离子方程式为________________________________________________________________________。
(2)元素Q、元素Z的含量影响钢铁性能,采用下图装置A在高温下将钢样中元素Q、元素Z转化为QO2、ZO2。
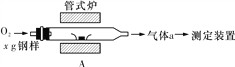
①气体a的成分是________________(填化学式)。
②若钢样中元素Z以FeZ的形式存在,在装置A中反应生成ZO2和稳定的黑色氧化物,则反应的化学方程式是:______________________________________________。
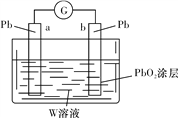
(3)用Z的最高价含氧酸W的溶液作电解质溶液(体积为1 L,假设反应前后溶液体积变化忽略不计)组装成原电池(如图所示)。则在a电极上发生的反应可表示为_________________。若电池工作一段时间后,a极消耗0.05 mol Pb,则W溶液的浓度由质量分数39%(密度为1.3 g/cm3)变为______mol/L(保留一位小数)。
【答案】 3Cu+8H++2NO===3Cu2++2NO↑+4H2O O2、SO2、CO2 5O2+3FeS![]() 3SO2+Fe3O4 Pb-2e-+SO
3SO2+Fe3O4 Pb-2e-+SO![]() === PbSO4 5.1
=== PbSO4 5.1
【解析】分析:X、Y、Z、M、Q、R是6种短周期元素,图表中数据分析,原子半径大小可知X、Y、Z为同周期元素,且为第三周期元素,结合化合价判断分别为:Mg、Al、S,M、Q为第二周期元素,结合化合价判断分别为:N、C,R为H元素,结合元素周期律、物质的性质和问题分析解答。
详解:根据以上分析可知X、Y、Z、M、Q、R分别为:Mg、Al、S、N、C、H,则
(1)元素M的最高价氧化物对应的水化物的稀溶液是稀硝酸,具有强氧化性,能与铜反应生成硝酸铜、NO和水,则发生反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。
(2)①该装置中C、S在A装置中被氧气反应生成二氧化碳、二氧化硫,还有部分氧气剩余,所以气体a的成分是SO2、CO2、O2;
②若钢样中S以FeS形式存在,在装置A中反应生成SO2和稳定的黑色氧化物,应该是四氧化三铁,Fe元素化合价由+2价变为+3价,-2价的S被氧化为+4价,结合电子得失守恒可知反应方程式为5O2+3FeS![]() 3SO2+Fe3O4;
3SO2+Fe3O4;
(3)a电极是铅,b电极表面涂有二氧化铅,则a电极是负极,电解质溶液是硫酸,则在a电极上发生的反应可表示为Pb-2e-+SO42-=PbSO4。总反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O,若电池工作一段时间后,a极消耗0.05 mol Pb,则消耗0.1mol硫酸。反应前硫酸的物质的量是![]() ,所以硫酸溶液的浓度变为(5.2mol-0.1mol)÷1L=5.1mol/L。
,所以硫酸溶液的浓度变为(5.2mol-0.1mol)÷1L=5.1mol/L。

【题目】下列实验操作与预期实验目的或所得实验结论一致的是
选项 | 实验操作和现象 | 预期实验目的或结论 |
A | 用洁净的铂丝蘸取某食盐试样,在酒精灯火焰上灼烧,火焰显黄色 | 说明该食盐不是加碘盐 |
B | 银氨溶液中滴入少量组成为C2H4O2的液态有机物,水浴微热,有银镜出现 | 可确定该有机物一定是甲酸甲酯 |
C | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡:I3-=I2+I- |
D | 浓硫酸与乙醇170℃共热,制得的气体通入酸性高锰酸钾溶液,溶液紫色褪去 | 制得的气体产物为乙烯 |
A. A B. B C. C D. D